
| A. | 0.2 mol•L-1 | B. | 0.1 mol•L-1 | C. | 2.0 mol•L-1 | D. | 1.0 mol•L-1 |
分析 已知I2+H2SO3+H2O=4H++SO42-+2I-,说明I2能氧化H2SO3,向含有HI和H2SO3的溶液里通入氯气,氯气先和亚硫酸反应生成硫酸,然后氯气再和碘离子反应生成碘单质,根据氧化还原反应中得失电子守恒计算原溶液中HBr和H2SO3的浓度.
解答 解:由I2+H2SO3+H2O=4H++SO42-+2I-可知,I2能氧化H2SO3,向含有HI和H2SO3的溶液里通入氯气,氯气先和亚硫酸反应生成硫酸,然后氯气再和碘离子反应生成碘单质,通入0.25molCl2,有二分之一的HI变为I2,
设原溶液中HI和H2SO3的浓度均为x,由电子守恒可知:
1L×x×(6-4)+1L×x×(1-0)×$\frac{1}{2}$=0.25×2×(1-0),
解得:x=0.2mol•L-1,
故选A.
点评 本题考查氧化还原反应的计算,为高考常见题型,题目难度中等,侧重于学生的分析能力和计算能力的考查,注意把握还原性的强弱及电子守恒为解答的关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定是第2周期元素 | B. | 一定是同一主族元素 | ||
| C. | 可能是第2、3周期元素 | D. | 可以相互化合形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和H2在一定条件下反应生成NH3 | B. | NO与O2反应生成NO2 | ||
| C. | NH3催化氧化生成NO和H2O | D. | 由NH3制NH4HCO3和(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
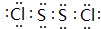 ;该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的化学方程式:2S2Cl2+2H2O=3S+SO2↑+4HCl;
;该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的化学方程式:2S2Cl2+2H2O=3S+SO2↑+4HCl;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
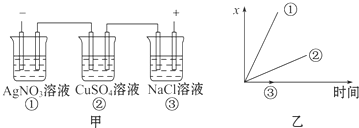
| A. | 各电解池析出气体体积总数的变化 | B. | 各电解池阳极质量的增加 | ||
| C. | 各电解池阴极质量的增加 | D. | 各电极上放电的离子总数的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性依次减弱,沸点依次升高 | |
| B. | NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏离子键和共价键 | |
| C. | 熔融状态下能导电的化合物一定含离子键 | |
| D. | CS2、BF3分子中所有的原子均为8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该烷烃的分子式为C5H12 | |
| B. | 反应所生成的有机产物能直接使AgNO3溶液褪色 | |
| C. | 该烷烃的四氯代物有2种 | |
| D. | 反应容器中,一氯代物所占的物质的量分数最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•(L•min)-1 | B. | v(B)=0.4mol•(L•s)-1 | ||
| C. | v(B)=0.3mol•(L•s)-1 | D. | v(C)=0.2mol•(L•s)-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com