【答案】
分析:(1)根据溶液的配制原理可知,用固体配制溶液的一般步骤为计算、称量、溶解转移、洗涤转移、定容摇匀.
(2)一定容积的容量瓶只能配制一定体积的溶液,配制1.00mol/L的NaCl溶液0.5L,所以需选用500ml的容量瓶.
根据具体的操作步骤,选择所需的仪器.
(3)具体分析操作对溶质的物质的量及溶液体积的影响,根据c=
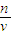
判断误差.
①未降至室温时,立即将溶液转移至容量瓶定容.溶液热胀冷缩,冷却后溶液体积小于500ml.
②盖倒转摇匀后,发现溶面低于刻度线,一部分溶液留在瓶塞与瓶口之间,又滴加蒸馏水至刻度,使溶液体积大于500ml.
解答:解:(1)根据溶液的配制原理可知,用固体配制溶液的一般步骤为计算、称量、溶解转移、洗涤转移、定容摇匀.
故答案为:计算、称量、溶解转移、洗涤转移、定容摇匀.
(2)配制1.00mol/L的NaCl溶液0.5L,所以需选用500ml的容量瓶.
称量需用药匙取氯化钠,溶解需要用烧杯,玻璃棒搅拌,转移过程中用玻璃棒引流.最后用胶头滴管定容.故还需仪器为
烧杯、药匙、玻璃棒、胶头滴管.
故答案为:500ml;烧杯、药匙、玻璃棒、胶头滴管.
(3)①未降至室温时,立即将溶液转移至容量瓶定容.溶液热胀冷缩,恢复到室温后溶液体积小于500ml,浓度偏高
故答案为:偏高;因恢复到室温后溶液体积小于500ml
②盖倒转摇匀后,发现溶面低于刻度线,一部分溶液留在瓶塞与瓶口之间,又滴加蒸馏水至刻度,使溶液体积大于500ml,溶液浓度偏低.
故答案为:偏低;溶液体积大于500ml.
点评:考查一定体积一定物质的量浓度溶液的配制,难度不大,关键清楚溶液配制原理.注意根据不当操作对n或V的影响通过c=
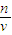
计算判断误差.

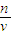 判断误差.
判断误差.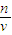 计算判断误差.
计算判断误差. 

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案 实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题
实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题