
����̫���ֽܷ�ˮ���ɵ��������ڴ��������������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء���֪H2(g)��CO(g)��CH3OH(l)��ȼ���Ȧ�H�ֱ�Ϊ��285.8 kJ��mol��1����283.0 kJ��mol��1�ͣ�726.5 kJ��mol��1����ش��������⣺
��1����̫���ֽܷ�10 molˮ���ĵ������� kJ��
��2��Һ̬�״�����ȫȼ������һ����̼�����Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
��3��
���ݻ�Ϊ2 L���ܱ������У���CO2��H2�ϳɼ״�����Ӧʽ��CO2(g)��3H2(g) CH3OH(g)��H2O(g)���������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ(ע��T1��T2������300 ��)��
CH3OH(g)��H2O(g)���������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ(ע��T1��T2������300 ��)��
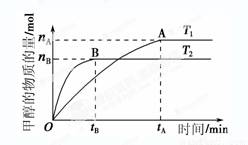
�ٿ��淴Ӧ��ƽ�ⳣ������ʽK��
������˵����ȷ����
A���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״�
��ƽ������Ϊv(CH3OH)�� mol��L��1��min��1
mol��L��1��min��1
B���÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С
C���÷�ӦΪ���ȷ�Ӧ
D������A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ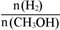 ����
����
����T1�¶�ʱ����1 mol CO2��3 mol H2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2��ת����Ϊ�����������ڵ�ѹǿ����ʼѹǿ֮��Ϊ ��
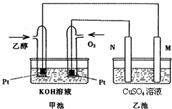
��4�� ��ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ���У��������ҺΪ���ԣ��ܷ�ӦʽΪ
2CH3OH + 3O2��2CO2��4H2O���������ķ�ӦʽΪ ��
�����ķ�ӦʽΪ ��[��
��1��2858 ��2��CH3OH(l)+O2(g)=CO(g)+2H2O(l) ��H= -- 443.5KJ��mol-1
��3����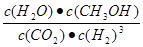 �� C D ��
�� C D ��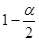 ��4��O2+4H++4e-=2H2O
CH3OH+H2O-6e-=CO2+6H+
��4��O2+4H++4e-=2H2O
CH3OH+H2O-6e-=CO2+6H+
��������
�����������1��1Ħ����������ȫȼ�ղ����ȶ���������ų�����Ϊ285.8
kJ.��1mol��ˮ�ֽ����1mol��������������285.8 kJ����ֽ�10 molˮ���յ�������2858 kJ����2�� COȼ�յ��Ȼ�ѧ����ʽΪ����CO(g)+1/2O2(g)=CO2(g)
��H=-283kl/mol; Һ̬�״���ȫȼ�յ��Ȼ�ѧ����ʽΪ����CH3OH(l)+3/2(g)=CO2(g)+ +2H2O(l) ��H=-726kl/mol��-��������CH3OH(l)+O2(g)=CO(g)+2H2O(l)
��H= - 443.5KJ/mol. ��3��
�ٿ��淴Ӧ��ƽ�ⳣ������ʽK��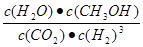 .��A �¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���ƽ������Ϊv(CH3OH)��
.��A �¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���ƽ������Ϊv(CH3OH)�� 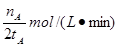 .����B ������T1�ﵽƽ��ʱ�״������ʵ���Ũ�ȱ���T2ʱ��˵��ƽ��ʱK1��K2.����C.�������¶�ΪT2ʱ�ȴﵽƽ�⣬˵��T2��T1�������¶ȣ��״��ĺ������ͣ�˵��ƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ����ƶ���������ӦΪ���ȷ�Ӧ����ȷ��D. ����A��ķ�Ӧ��ϵ��T1���ߵ�T2���ﵽƽ��ʱn(H2) ����n(CH3OH)��С������n(H2)/n(CH3OH) ������ȷ����ȷѡ��ΪCD���ۿ�ʼʱͨ��1 mol CO2��3 mol H2����ַ�Ӧ�ﵽƽ�����CO2��ת����Ϊ������ﵽƽ��ʱ��ַ�Ӧ�ﵽƽ�����CO2Ϊ(1-��)mol, H2Ϊ3(1-��)mol,
n(CH3OH)= �� mol, n(H2O)= �� mol. ��������һ�ܱպ��������У����������ڵ�ѹǿ����ʼѹǿ֮��ΪΪ��Ӧǰ�����������ʵ����ıȡ�ƽ��ʱ��������ʵ���Ϊ(1-��)mol+3(1-��)mol+�� mol+ �� mol.=(4-2��)mol,��ʼʱ��������ʵ���Ϊ4mol���������ڵ�ѹǿ����ʼѹǿ֮��Ϊ(4-2��)mol��4mol=
.����B ������T1�ﵽƽ��ʱ�״������ʵ���Ũ�ȱ���T2ʱ��˵��ƽ��ʱK1��K2.����C.�������¶�ΪT2ʱ�ȴﵽƽ�⣬˵��T2��T1�������¶ȣ��״��ĺ������ͣ�˵��ƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ����ƶ���������ӦΪ���ȷ�Ӧ����ȷ��D. ����A��ķ�Ӧ��ϵ��T1���ߵ�T2���ﵽƽ��ʱn(H2) ����n(CH3OH)��С������n(H2)/n(CH3OH) ������ȷ����ȷѡ��ΪCD���ۿ�ʼʱͨ��1 mol CO2��3 mol H2����ַ�Ӧ�ﵽƽ�����CO2��ת����Ϊ������ﵽƽ��ʱ��ַ�Ӧ�ﵽƽ�����CO2Ϊ(1-��)mol, H2Ϊ3(1-��)mol,
n(CH3OH)= �� mol, n(H2O)= �� mol. ��������һ�ܱպ��������У����������ڵ�ѹǿ����ʼѹǿ֮��ΪΪ��Ӧǰ�����������ʵ����ıȡ�ƽ��ʱ��������ʵ���Ϊ(1-��)mol+3(1-��)mol+�� mol+ �� mol.=(4-2��)mol,��ʼʱ��������ʵ���Ϊ4mol���������ڵ�ѹǿ����ʼѹǿ֮��Ϊ(4-2��)mol��4mol=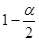 ����4�� �Լ״�Ϊȼ�ϵ�ȼ�ϵ���У��������ҺΪ���ԣ���ص��ܷ�ӦʽΪ2CH3OH + 3O2��2CO2��4H2O��ͨ��״��ĵ缫Ϊ�����������ķ�ӦʽΪCH3OH+H2O-6e-=CO2+6H+��ͨ�������ĵ缫Ϊ�����������ķ�ӦʽO2+4H++4e-=2H2O
����4�� �Լ״�Ϊȼ�ϵ�ȼ�ϵ���У��������ҺΪ���ԣ���ص��ܷ�ӦʽΪ2CH3OH + 3O2��2CO2��4H2O��ͨ��״��ĵ缫Ϊ�����������ķ�ӦʽΪCH3OH+H2O-6e-=CO2+6H+��ͨ�������ĵ缫Ϊ�����������ķ�ӦʽO2+4H++4e-=2H2O
���㣺�����Ȼ�ѧ����ʽ����д����������Ի�ѧƽ���Ӱ�졢��ѧƽ�ⳣ���ļ��㡢���Pȼ�ϵ�صķ�Ӧԭ����֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧ��Ӧ�е������仯������Ϊ���ܡ����ܵ� |
| B����������������ú��ʯ�ͣ���ˣ��������ڿ�������Դ |
| C��ͨ�������������ķ��տ�ʹ���е���������ת������ |
| D��ʹ�ô�������̫���ֽܷ�ˮ�����ܲ�������Ҫ;�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2009-2010ѧ�꽭��ʡ������������ľ�¸���ѧ��һ���£����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵������ȷ����
A����ѧ��Ӧ�е������仯������Ϊ���ܡ����ܵ�
B����������������ú��ʯ�ͣ���ˣ��������ڿ�������Դ
C��ͨ�������������ķ��տ�ʹ���е���������ת������
D��ʹ�ô�������̫���ֽܷ�ˮ�����ܲ�������Ҫ;��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com