
| A. | 含有金属元素 | B. | 具有较高的熔点 | C. | 水溶液能导电 | D. | 熔融状态能导电 |
分析 某种化合物中一定存在离子键,说明该化合物中是离子化合物,离子化合物在熔融状态下能导电,共价化合物在熔融状态下不能导电,据此分析解答.
解答 解:某种化合物中一定存在离子键,说明该化合物中是离子化合物,离子化合物在熔融状态下能导电,共价化合物在熔融状态下不能导电,
A.含有金属元素的化合物不一定含有离子键,如氯化铝,故A错误;
B.具有较高熔点的化合物不一定含有离子键,如二氧化硅等,故B错误;
C.水溶液能导电的化合物不一定含有离子键,如HCl、硫酸等,故C错误;
D.熔融状态能导电的化合物中含有只有一定阴阳离子,所以一定含有离子键,故D正确;
故选D.
点评 本题考查离子化合物的判断,侧重考查基本概念,明确离子化合物和共价化合物的根本区别是解本题关键,注意不能根据溶解性、电解质溶液酸碱性及导电能力强弱判断离子化合物.


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | N 2为0.2 mol•L-1,H 2为0.6 mol•L-1 | |
| B. | N 2为0.15 mol•L-1 | |
| C. | N 2、H 2均为0.18 mol•L-1 | |
| D. | NH 3为0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨作为清洁能源的反应原理是4NH3+5O2$→_{△}^{催化剂}$4NO+6H2O | |
| B. | 液氨可以作为溶剂使用,而氢的沸点极低,不易液化 | |
| C. | 氨气比空气轻,标准状况下密度约为0.76 g•L-1 | |
| D. | 氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 | |
| B. | 除去乙烷中混有乙烯,将混合气体通入酸性高锰酸钾溶液 | |
| C. | 用燃烧的方法鉴别甲烷与乙炔 | |
| D. | 用溴水鉴别苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属 | B. | 周期表右上角非金属元素 | ||
| C. | 金属与非金属分界线附近的元素 | D. | 过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
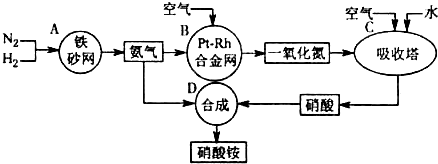
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH3COONa中含有的共用电子对总数为8NA | |
| B. | 标准状况下,将22.4LCl2溶于水,反应转移电子数为NA | |
| C. | 450℃时,在催化剂的作用下,将2molSO2与一定量的O2混合反应,一段时间后测得SO2消耗了$\frac{1}{2}$,则该正反应消耗了NA个SO2分子 | |
| D. | 78gNa2O2和Na2S的混合物中含有的阴离子数目一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的最外层电子数比Y原子最外层电子数多 | |
| B. | X的最高价氧化物水化物的酸性比Y的最高价氧化物水化物的酸性强 | |
| C. | 与H2化合时X形成的单质比Y形成的单质容易 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com