
| A. | 已知:正丁烷稳定性小于异丁烷,则CH3CH2CH2CH3(g)→(CH3)2CHCH3(g)△H>0 | |
| B. | 已知:OH-(ag)+H+(aq)═H2O(l)△H=-57.4 kJ/mol则含20.0g NaOH的稀溶液与稀醋酸完全中和,放出28.7kJ的热量 | |
| C. | 已知:2H2O(l)═2H2(g)+O2(g)△H=+483.6 kJ•mol-1,则氢气的燃烧热为241.8kJ/mol | |
| D. | 己知:2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
分析 A.正丁烷稳定性小于异丁烷,异丁烷稳定,则CH3CH2CH2CH3(g)→(CH3)2CHCH3(g)需要放热;
B.醋酸电离吸热;
C.燃烧热为1mol氢气燃烧生成液态水的能量变化,且互为逆反应的焓变数值相同、符号相反;
D.完全燃烧放出热量多,焓变为负.
解答 解:A.能量越高越不稳定,由于正丁烷稳定性小于异丁烷,则CH3CH2CH2CH3(g)→(CH3)2CHCH3(g)△H<0,故A错误;
B.醋酸为弱酸,电离出氢离子的过程为吸热过程,所以含20.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.7kJ,故B错误;
C.燃烧热是指:25℃、101kPa下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的能量,则2H2O(l)═2H2(g)+O2(g)△H=+483.6 kJ•mol-1,可知H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-241.8 kJ•mol-1,则氢气的燃烧热为241.8kJ/mol,故C正确;
D.完全燃烧放出热量多,对应的△H越小,则△H1<△H2,故D错误;
故选C.
点评 本题考查热化学方程式,为高频考点,把握稳定性与能量的关系、反应中能量变化为解答该题的关键,侧重分析与应用能力的考查,注意燃烧热、中和热的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=a+1 | |
| B. | 在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 常温下,1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L 盐酸的pH=8.0 | |
| D. | 电解质不一定导电,导电物质不一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+H+═H2O+CO2 | |
| B. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2 | |
| C. | 硝酸与氢氧化钡反应:OH-+H+═H2O | |
| D. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发太阳能、水能、风能、地热能等新能源 | |
| B. | 大力开采煤、石油和天然气,以满足人们日益增长的能源需求 | |
| C. | 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 | |
| D. | 减少资源消耗,注重资源的重复使用、资源的循环再生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:
氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用的氢氧化钠固体放置于空气中过久 | |
| B. | 定容时,眼睛俯视刻度线 | |
| C. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| D. | 定容后摇匀,发现液面低于刻度线,不作处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
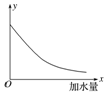
| A. | 溶液中OH-的物质的量浓度 | B. | 溶液的导电能力 | ||
| C. | 溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ | D. | CH3COOH的电离程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com