
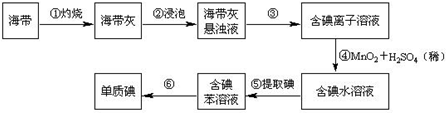
 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如下:
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如下:


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
| A、含氧原子个数比为2:3 |
| B、含氧元素质量比为5:6 |
| C、含硫原子个数比为5:4 |
| D、含硫元素质量比为4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通CO的一极是电池的正极 |
| B、负极电极反应是:O2+2CO2+4e-=2CO32- |
| C、熔融盐中CO32-的物质的量在工作时保持不变 |
| D、电池工作时,CO32-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀的生成和溶解不断进行,但速率相等 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度增大 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3的溶解度小于CaSO4 |
| B、沉淀转化的实质是沉淀溶解平衡的移动 |
| C、沉淀转化的难易与溶解度差别的大小无关 |
| D、CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:


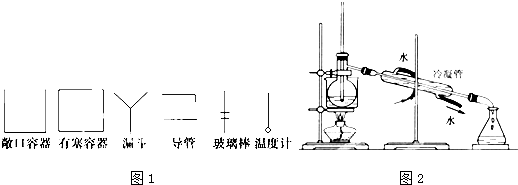
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com