
【题目】将![]() 溶液和
溶液和![]() 盐酸等体积混合,在混合溶液中,下列关系式正确的是
盐酸等体积混合,在混合溶液中,下列关系式正确的是
A.![]()
B.![]()
C.![]()
D.![]()
【答案】B
【解析】
混合后发生反应:Na2CO3+HCl=NaCl+NaHCO3,混合溶液中含三种溶质(Na2CO3、NaCl、NaHCO3)且物质的量浓度相等。
A.电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(HCO3-)+2c(CO32-),故A错误;
B. CO32-的水解程度大于HCO3-,且溶液呈碱性,故c(Na+)> c(HCO3-)> c(Cl-)> c(CO32-)> c(OH-)> c(H+),故B正确;
C.物量守恒式应为c(Na+)=2 c(HCO3-)+2c(CO32-)+2c(H2CO3),故C错误;
D.根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(HCO3-)+2c(CO32-),物料守恒c(Na+)=2 c(HCO3-)+2c(CO32-)+2c(H2CO3),联立可得c(OH-)+c(Cl-)=c(HCO3-)+2c(H2CO3)+c(H+),故D错误;
答案:B


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】液态化合物AB会发生微弱的自身电离,电离方程式为AB![]() A++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是 ( )。
A++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是 ( )。
A.c(A+)随温度升高而降低
B.在35 ℃时,c(A+)>c(B-)
C.AB的电离程度(25 ℃)>(35 ℃)
D.AB的电离是吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子中含有的质子数都为10,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:
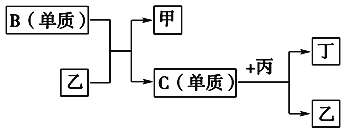
(1)写出B+乙―→甲+C的化学反应方程式______________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________(填写序号)。
①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:
①甲与丙以及乙与丙均能够发生反应,②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:
写出上述第四种元素在周期表中的位置________________。写出C+丙―→乙+丁的化学反应方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对一些实验事实的理论解释正确的是( )
选项 | 实验事实 | 理论解释 |
A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
B | SO2为V形分子 | SO2分子中S原子采用sp3杂化 |
C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层数;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为______________,Y的轨道表示式为_________________;
(2)YX2的电子式是______________,分子构型为_________,中心原子发生了____杂化。
(3)Y与Z形成的化合物的分子式是_______,该化合物中化学键是________键(填“极性”或“非极性”),该分子属于__________分子(填“极性”或“非极性”)。
(4)Y的氢化物中分子构型为正四面体的是_______(填名称),键角为_______,中心原子的杂化形式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.取用固体![]() 时动作一定要轻
时动作一定要轻
B.蒸馏提纯乙醇的实验中,应将温度计水银球置于被加热的酒精中
C.容量瓶、滴定管、分液漏斗等仪器在使用之前都必须检漏
D.量取5.2 mL硫酸铜溶液用到的仪器有10 mL量筒、胶头滴管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对图像的叙述正确的是
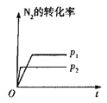
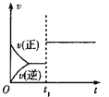
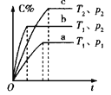
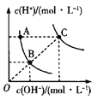
甲 乙 丙 丁
A.图甲可表示压强对反应:![]()
![]() 的影响
的影响
B.图乙中,![]() 时刻改变的条件一定是加入了催化剂
时刻改变的条件一定是加入了催化剂
C.若图丙表示反应:![]() ,则
,则![]() 、
、![]()
D.图丁表示水中![]() 和
和![]() 的关系,ABC所在区域总有
的关系,ABC所在区域总有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法测得其中含C 72.0%、 H 6.67%,其余为氧,质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法:
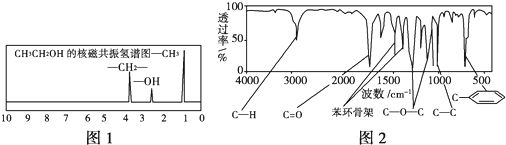
方法一:核磁共振仪可以测定有机物分子里不同化学环境的氢原子及其相对数量。如乙醇(CH3CH2OH)的核磁共振氢谱有3个峰,其面积之比为3:2:1,如图1所示,现测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3;
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图2所示。
已知:A分子中只含一个苯环,且苯环上只有一个取代基,试回答下列问题:
(1)A的分子式为:_______________
(2)A的结构简式为(写出两种): ___________________、________________ 。
(3)A的芳香类同分异构体有多种,请按要求回答下列问题:
①分子中不含甲基的芳香酸: ___________________________;
②属于酚类且苯环上只有两个取代基的芳香醛共有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
(1)为快速得到乙醇气体,可采取的方法是 ;
若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是 (填写编号);
a.取下小试管 b.移去酒精灯 c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中出现的现象为 。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。

①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有Fe2+和Fe3+,检验该溶液中的Fe2+的方法是 ;
关于M中铁元素价态的判断正确的是 (填写编号)。
a.一定有+3价和+2价铁,无0价铁
b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,无+2价铁
d.一定有+3和+2价铁,可能有0价铁
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置和步骤如下:

①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是 (填写编号)
a.①⑤④③②⑥⑦⑧ b.①③⑤④②⑦⑥⑧ c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中![]() = 。
= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com