
 =CH-C≡C-CF3中处于同一平面内的原子最多可能是( )
=CH-C≡C-CF3中处于同一平面内的原子最多可能是( )| A. | 12个 | B. | 14个 | C. | 18个 | D. | 20个 |
分析 在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断.注意单键可以旋转.
解答 解:在CH3- -CH=CH-C≡C-CF3分子中,甲基中C原子处于苯中H原子的位置,甲基通过旋转碳碳单键会有1个H原子处在苯环平面内,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子(苯环上6个、甲基中2个、碳碳双键上2个、碳碳三键上2个)共面,可能共平面的氢原子有甲基中1个,苯环中4个,碳碳双键上2个,F原子有一个可能共平面,所以共平面的原子最多为20个,
-CH=CH-C≡C-CF3分子中,甲基中C原子处于苯中H原子的位置,甲基通过旋转碳碳单键会有1个H原子处在苯环平面内,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子(苯环上6个、甲基中2个、碳碳双键上2个、碳碳三键上2个)共面,可能共平面的氢原子有甲基中1个,苯环中4个,碳碳双键上2个,F原子有一个可能共平面,所以共平面的原子最多为20个,
故选D.
点评 本题考查有机物结构中共面、共线问题,难度中等,关键是空间想象,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构,单键可以旋转,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应属于熵增放热反应,一定能自发进行 | |
| B. | 5 min 内 H2 的平均反应速率为 0.1 mol/(L•min) | |
| C. | 其它条件不变的情况下,加入催化剂可提高 CO 的转化率 | |
| D. | 若该温度下,反应物的起始浓度 c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则 a=5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以通过电解熔融AlCl3来冶炼铝 | |
| B. | HF的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 非极性键不只存在于双原子单质分子中 | |
| D. | 分解反应都是吸热反应,化合反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 点①时:c(CN-)>c(Na+)>c(HCN)>c(OH-) | |
| B. | 点③时:c(Na+)=c(CH3COO-)>c(H+) | |
| C. | 点④时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
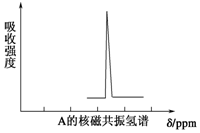 有一种新合成的高度对称的有机物A.已知10.4g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重7.2g和35.2g,经检验剩余气体为O2.
有一种新合成的高度对称的有机物A.已知10.4g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重7.2g和35.2g,经检验剩余气体为O2.
 ,其核磁共振氢谱有5个吸收峰.
,其核磁共振氢谱有5个吸收峰.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无论是风力发电还是火力发电,都是将化学能转化为电能 | |
| B. | PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 | |
| C. | 硫的氧化物和氮的氧化物是形成酸雨的主要物质 | |
| D. | “无磷洗涤剂”的推广使用,不能有效减少水体富营养化的发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com