
将一定质量的铁粉加入到装有100 ml某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有m g的铁粉,收集到NO气体448 ml(标准状况下)。
①所得溶液中的溶质的化学式是____________;
②原硝酸溶液的物质的量浓度为__________ mol/L。
(2)向上述固-液混合物中逐滴加入稀硫酸直到刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉n g。
①此时溶液中溶质的化学式是 ____________ ;
②m-n的值为(计算精确到0.1g)____________ g 。
科目:高中化学 来源: 题型:阅读理解
| ① | ② | ③ | |
| 硫酸溶液体积/mL | 50 | 50 | 50 |
| 称取铁钉质量/g | 5.0 | 6.0 | 7.0 |
| 再投入铜粉质量/g | 1.0 | 1.0 | 1.0 |
| 标准状况下的体积/L | 1.97 | 2.24 | 2.24 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省七市(州)高三4月联考模拟试卷理综化学试卷(解析版) 题型:填空题
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
(1)一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为______。
(2)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是______ (填编号)。
a.溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物为Cu d.溶液中有Fe2+,不溶物为Cu、Al
(3)将一定质量的铁、铝、铜合金,加入lL一定物质的量浓度的硝酸中,合金完全溶解,测得溶液中(忽略溶液体积的变化)c(H+)=0.5mol/L、c(Cu2+)=0.3mol/L、c(Al3+)=0.2mol/L、c(NO3-)=2mol/L,则混合物中铁的质量为______。
(4)铁的某种氧化物的化学式表示为FexO(x<1),已知铁元素在该氧化物中的质量分数为75%,则x=______ (精确至0.01)。
(5)Na-AI/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变。
①若该正极的电极反应式表示为:2Na++FeS+2e-=Na2S+Fe,则电池的负极反应式可表示为_____;充电时,阳极发生反应的物质是______。
②用该电池作电源,组成如图所示装置,若通电5min时,铜电极质量增加1.08 g,则该电源电极X名称为______。图中装置A、C的pH变化为:A ______、C ______ (填“增大” “减小”或“不变”)。

查看答案和解析>>
科目:高中化学 来源:河北省期末题 题型:填空题
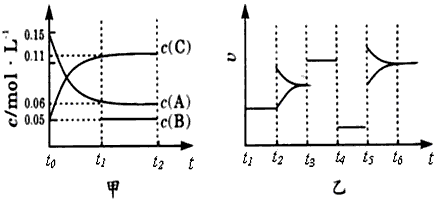
查看答案和解析>>
科目:高中化学 来源:河北省期末题 题型:填空题
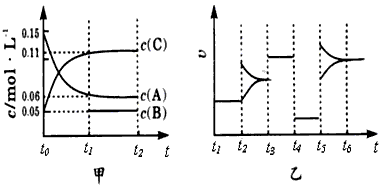
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com