
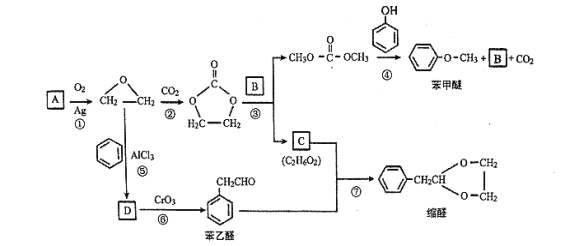
����Ŀ��A (C2H4)�ǻ������л�����ԭ�ϡ���A�ͳ������л���ɺϳ�һ���������Ϻ�һ����ȩ�����ϣ�����ϳ�·����ͼ��ʾ�����ַ�Ӧ������ȥ)��
��֪��![]()
�ش��������⣺
��1��B�ķ���ʽ��_______��C�к��еĹ�����������_______��
��2����DΪ��ȡ�������廯��������������Ʒ�Ӧ��ÿ��D������ֻ����1����ԭ�ӣ� D����Ԫ�ص���������ԼΪ13.1%����D�Ľṹ��ʽΪ_______���ķ�Ӧ������_______��
��3���ݱ�������Ӧ�����������£���NaHSO4��H2OΪ�������У���д���˷�Ӧ�Ļ�ѧ����ʽ��_______��
��4����д���������������ı���ȩ������ͬ���칹��Ľṹ��ʽ��_______��
i .���б����ͽṹ![]()
ii.�˴Ź���������4��壬�ҷ����֮��Ϊ3 : 2 : 2 : 1
��5����������EΪ�����ѵ�ͬϵ�����Է��������ȱ����Ѵ�14������ʹFeCl3��Һ��ɫ��E������ͬ���칹�干��_______ (�����������칹)�֡�
��6������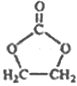 �ĺϳ�·�ߣ�д����2-�ȱ���ͱ�Ҫ�����Լ��Ʊ�
�ĺϳ�·�ߣ�д����2-�ȱ���ͱ�Ҫ�����Լ��Ʊ�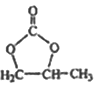 �ĺϳ�����ͼ��_______��
�ĺϳ�����ͼ��_______��
���𰸡�CH4O �ǻ� 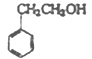 ������Ӧ
������Ӧ 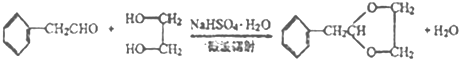
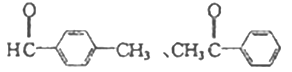 9
9 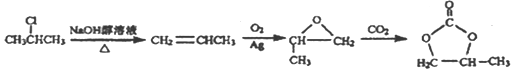
��������
A�ķ���ʽ��C2H4����֪A����ϩ�����������ñ�ɻ������顣���������������̼��������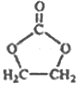 ������Ϣ��ʾ�У������봼������������Ӧ���ٽ�ϲ��B�Ǽ״���CΪHOCH2CH2OH���������鷢����Ӧ������D��D���������ɱ���ȩ��D�������Ʒ�Ӧ��D��Oԭ�ӵ���������Ϊ13.1%��D��ֻ��1��Oԭ�ӣ��ɵ�D����Է�������
������Ϣ��ʾ�У������봼������������Ӧ���ٽ�ϲ��B�Ǽ״���CΪHOCH2CH2OH���������鷢����Ӧ������D��D���������ɱ���ȩ��D�������Ʒ�Ӧ��D��Oԭ�ӵ���������Ϊ13.1%��D��ֻ��1��Oԭ�ӣ��ɵ�D����Է�������![]() ����ȥ��ԭ�ӵ����ԭ����������106������8��Cԭ�ӣ�10��Hԭ�ӣ�����ʽΪC8H10O�������������DΪ���Ҵ���
����ȥ��ԭ�ӵ����ԭ����������106������8��Cԭ�ӣ�10��Hԭ�ӣ�����ʽΪC8H10O�������������DΪ���Ҵ���
��1�����ݷ�������֪BΪ�״�������ʽΪCH4O��CΪHOCH2CH2OH��C�й�����Ϊ�ǻ���
��2��D�������Ʒ�Ӧ��D��Oԭ�ӵ���������Ϊ13.1%��D��ֻ��1��Oԭ�ӣ��ɵ�D����Է�������![]() ����ȥ��ԭ�ӵ����ԭ����������106������8��Cԭ�ӣ�10��Hԭ�ӣ�����ʽΪC8H10O��D���������ɱ���ȩ��DΪ���Ҵ����ṹ��ʽΪ��
����ȥ��ԭ�ӵ����ԭ����������106������8��Cԭ�ӣ�10��Hԭ�ӣ�����ʽΪC8H10O��D���������ɱ���ȩ��DΪ���Ҵ����ṹ��ʽΪ��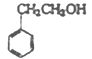 ����������ȩ����Ӧ��Ϊ������Ӧ��
����������ȩ����Ӧ��Ϊ������Ӧ��
��3��CΪ�Ҷ������ٸ���ԭ���غ㣬�ɼ�C�뱽��ȩ��Ӧ������ȩ��ͬʱ��������ˮ������д������ʽΪ��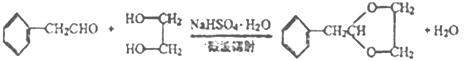 ��
��
��4������ȩ��ͬ���칹�庬�б�����![]() ������Ϊȩ��ͪ���˴Ź������������Ϊ3 : 2 : 2 : 1���÷�����һ��8��Hԭ�ӣ�����1����������������ͬ���칹��Ľṹ��ʽΪ
������Ϊȩ��ͪ���˴Ź������������Ϊ3 : 2 : 2 : 1���÷�����һ��8��Hԭ�ӣ�����1����������������ͬ���칹��Ľṹ��ʽΪ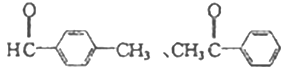 ��
��
��5��������EΪ�����ѵ�ͬϵ�����Է��������ȱ����Ѵ�14���ȱ����Ѷ�1��CH2����ʹFeCl3��Һ��ɫ������֪���з��ǻ�����������ȡ����Ϊ���ǻ���2������6�֣���������ȡ����Ϊ���ǻ���1���һ�����3�֣�����һ��9�֣�
��6��A�������������ɻ������飬�ٺ�CO2���� ��Ŀ�����
��Ŀ�����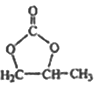 ��֮�����ƣ�����ģ�·�Ӧ�٢ڣ�����A����ϩ����ԭ����2-�ȱ��飬Ҫ�õ���ϩ������Ϊ�������ƵĴ���Һ������ͼΪ��
��֮�����ƣ�����ģ�·�Ӧ�٢ڣ�����A����ϩ����ԭ����2-�ȱ��飬Ҫ�õ���ϩ������Ϊ�������ƵĴ���Һ������ͼΪ��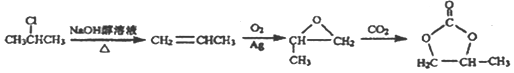 ��
��
������ȡ���� | A | AA | AB | AAA | AAB | ABC |
ͬ���칹����Ŀ | 1 | 3 | 3 | 3 | 6 | 10 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�������ȩ(CCl3CHO)�ķ�Ӧԭ��ΪC2H5OH+4Cl2��CCl3CHO+5HCl�����ܷ����ĸ���Ӧ��C2H5OH+HCl��C2H5Cl+H2O��ij̽��С��ģ���Ʊ�������ȩ��ʵ��װ����ͼ��ʾ(�г֡�����װ�þ���ȥ)��
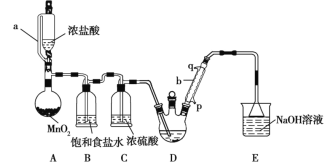
�ش��������⣺
(1)������a������ͨ��Һ©����Ŀ����_______________��
(2)װ��A��MnO2������KMnO4���棬��Ӧ�����ڳ����½��У���д����Ӧ�����ӷ���ʽ________________��
(3)����b������ˮӦ��_______(����p������q��)�ڽ���
(4)����ȥװ��B����ʵ���Ӱ����______________��
(5)��֪��CCl3CHO+OH-��CHCl3+HCOO-��HCOO-+I2=H++2I-+CO2����I2+2S2O32-=2I-+S4O62-����ȡ0.40 g��Ʒ����ɴ�����Һ������20.00 mL 0.100 mol/L�����Һ���ټ�������Na2CO3��Һ����Ӧ��ȫ�����������Һ��pH����������0.020 mol/L��Na2S2O3��Һ�ζ����յ㡣�ظ���������3�Σ�ƽ������Na2S2O3��Һ20.00 mL���ζ�ʱ����ָʾ����________���ﵽ�ζ��յ�ʱ��������______________����øò�Ʒ�Ĵ���Ϊ_____�����ζ���������ˮϴ����û����Na2S2O3��Һ��ϴ����ⶨ�����_______(����ƫ��������ƫС������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ�� CO(g) + 2H2(g) ![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��Ӧ�� CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ɱ��������ж���H1____0 ������������������������������
�� ij�¶��£���2mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0.2 mol��L����CO��ת����Ϊ___________����ʱ���¶�Ϊ_______�����ϱ���ѡ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) + 3O2(g) �� 2CO2(g) + 4H2O(l) ��H1����1451.6kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2 ����566.0kJ��mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��_________________________________________
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�

�ٸõ�ص�����ת����ʽΪ___________________________��
�ڹ���һ��ʱ������Һ��pH��С����д���õ�صĸ����ĵ缫��Ӧʽ��_____________________________
���øõ�ص�⣨���Ե缫��500mLijCuSO4��Һ�����һ��ʱ���Ϊʹ�������Һ�ָ���ԭ״̬����Ҫ����Һ�м���9.8g Cu(OH)2���塣��ԭCuSO4��Һ�����ʵ���Ũ��Ϊ___________mol/L��������ǰ����Һ������䣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��������ý���ϣ���Ҫ�ɷ�ΪNi-Al�Ͻ𣬻�������Fe��Cu��Zn���л�� �Ʊ�NiO�����ս�����Դ������������ʾ��

��֪������������1�ͱ�2��ʾ
��1�������ܵ���ʵ��ܶȻ�������25�棩
���� | Ksp | ���� | Ksp |
Fe(OH)3 | 4.0��10-38 | CuS | 6.3��10-34 |
Fe(OH)2 | 1.8��10-16 | ZnS | 1.6��10-24 |
Al(OH)3 | 1.0��10-33 | NiS | 3.2��10-18 |
Ni(OH)2 | 2.0��10-15 |
��2 ԭ�ϼ۸��
���� | �۸�/��Ԫ��-1�� |
ƯҺ����25.2%NaClO�� | 450 |
˫��ˮ����30%H2O2�� | 2400 |
�ռ��98%NaOH�� | 2100 |
�����99.5%Na2CO3�� | 600 |
��ش��������⣺
��1�������ա���Ŀ����________________________________��
��2�����Լ�a��������Ϊ__________________��ѡ����Լ���������______��
��3����������ʱ��Ӧ�����ӷ���ʽΪ__________________________________________��
��4����ʹ��Һ��Fe3+��A13+��Ũ�Ⱦ�С�ڵ���1.0��10-6 mol L-1���衰����pH������Ϊ_______________��
��5�����Լ�b��Ӧѡ��__________������ˮ��С�ʱ����Ӧ�Ļ�ѧ����ʽΪ_______________________________��
��6�����������һ��Ӧ�ù㷺�Ķ��ε�أ��ŵ�ʱ���õ�ص��ܷ�ӦΪNiOOH+MH=Ni(OH)2+M��������������2 mol����ʱ�������ϸ�����������__________g�����ʱ��������ӦʽΪ_______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ����H1=��393.5 kJmol-1����H2=��395.4 kJmol-1������˵�����ʾʽ��ȷ���ǣ� ��

A. C��s��ʯī��==C��s�����ʯ����H=+1.9kJmol-1
B. ʯī�ͽ��ʯ��ת���������仯
C. ���ʯ���ȶ���ǿ��ʯī
D. 1 molʯī���ܼ��ܱ�1 mol���ʯ���ܼ���С1.9 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�̶�������ܱ������м��뷴Ӧ��A��B���������·�Ӧ��A+2B=3C����Ӧ��2min��A��Ũ�ȴӿ�ʼʱ��1.0mol/L����0.8 mol/L����֪��Ӧ��ʼʱB��Ũ����1.2 mol/L����
��1����A����ʾ2 min�ڸ÷�Ӧ��ƽ������______��
��2��2minĩC��Ũ��_______��
��3��2minĩB��ת����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������������������A��ʳ�Σ� B��ʳ����C��ƻ��֭��D����������E����ù�أ��밴����Ҫ�����(�����)��
����ά����C����____����ֱ�ӽ���ѪҺ��������������___ ��Ӧ����㷺�Ŀ�����֮һ����____��������Ϊ��ζ�����ֿ���Ϊ����������ɫ������____��ʳ�ù��������Ѫѹ���ߡ����������____��
��2����֪ά����A1�ļ���ʽ���£��ߵĽ�����˵㴦����̼ԭ�ӣ�������ԭ�Ӳ����ļۣ���C��Hԭ��δ��dz�����

�ش��������⣺
��ά����A��һ����Ҫ��ά���أ��ֳ��ӻƴ���������_____������ˮ����������֬��������ά���أ����������ȱ��ά����A����_____���ۼ�����дһ�֣��� ά����A�����ϸߵ��߲���______��
��ά����A1�Ľṹ��ʽ����ͼ���Ʋ���____ʹ��ˮ��ɫ������������������������1molά����A1�������ɸ�_____mol H2�����ӳɷ�Ӧ��
��3�����ֽྻ��ȫ�����滷���ѳ�Ϊȫ����Ĺ�ʶ��
��Ϊ�˸��ƿ���������������ƴ����ж�������������̳�����Ⱦ����ŷ�����Ϊ���ƴ����ж���������ŷţ�����ȡ�Ĵ�ʩ�ǶԻ�ʯȼ�Ͻ���______����������װβ��������װ�ã�ʹ���е��к�����NO��COת��Ϊ�����壬�÷�Ӧ�Ļ�ѧ����ʽΪ______��
�ڻ�ýྻ��ȫ������ˮ��ÿ���˵�������Ҫ��ijũ�����Ϊ�������ˮ���ڽ��ر�ˮȡ�ؼҺ�ʹ��Ư�ۻ�Ư��Ƭ����ɱ����������ԭ�����û�ѧ����ʽ��ʾΪ_______��
���������������Ӧ���з�����ա����д�����������ˣ��Ի�ʣ�����������˱����ʣ��������һ�������������������⣬����һ���ܹ��ı���������ɡ��ṹʹ�������С����������������е�������ʹ֮�����Ĵ�����ʽ�����������Ĵ�����ʽ��_____������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƫ��������N2O4�dz��õĻ���ƽ��������߷������»�ѧ��Ӧ��(CH3)2NNH2(l)+2N2O4(l)��2CO2(g)+3N2(g)+4H2O(g) (��)
��1����Ӧ(��)����������_________��
��2������к��г����ֺ���ɫ���壬����Ϊ��N2O4(g)![]() 2NO2(g)(��)�����¶�����ʱ��������ɫ�����Ӧ(��)Ϊ____________(����ȡ����ȡ�)��Ӧ��
2NO2(g)(��)�����¶�����ʱ��������ɫ�����Ӧ(��)Ϊ____________(����ȡ����ȡ�)��Ӧ��
��3��550��ʱ����2.0molSO2��1.0molO2����5L�ܱ������У���Ӧ��ƽ������д�ʩ����ʹn(SO3)/n(SO2)�������_____________��
A.�����¶�
B.����He(g)��ʹ��ϵ��ѹǿ����
C.�ٳ���2.0molSO2��1.0molO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�����û�ԭ���۴�����Fe(NO3)3��Cu(NO3)2��HNO3�ķ�ˮ�����ӻ�ԭ���۵���������Һ��Fe2+��Ũ�ȱ仯��ϵ����ͼ��������Һ����仯���������йؽ��۴������

A. ������������С��56gʱ�����ķ�ӦΪFe+NO3��+4H+=Fe3++NO��+2H2O
B. �������������������168g����Һ�е�����ֻ����Fe(NO3)2������Fe2+��ˮ�⣩
C. ԭ��ˮ���������ʵ���������ǿ������˳����HNO3>Fe(NO3)3>Cu(NO3)2
D. ԭ��ˮ��Fe(NO3)3��Ũ��Ϊ2mol/L��Cu(NO3)2��Ũ�Ⱦ�Ϊ1mol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com