
分析 (1)该反应中Fe元素化合价由+2价变为+3价,还原剂失电子化合价升高;
(2)该反应中Fe元素化合价由+3价变为+2价,则铁离子作氧化剂,需要还原剂才能实现;
(3)碳酸氢钠和稀盐酸反应生成NaCl、二氧化碳和水;氢氧化铝和稀盐酸反应生成氯化铝和水.
解答 解:(1)该反应中Fe元素化合价由+2价变为+3价,还原剂失电子化合价升高,所以亚铁离子作还原剂,
故答案为:还原;
(2)该反应中Fe元素化合价由+3价变为+2价,则铁离子作氧化剂,需要还原剂才能实现,所以维生素C是还原剂,故答案为:还原;
(3)碳酸氢钠和稀盐酸反应生成NaCl、二氧化碳和水;氢氧化铝和稀盐酸反应生成氯化铝和水,离子方程式分别为HCO3-+H+═CO2↑+H2O、Al(OH)3+3H+═Al3++3H2O,
故答案为:HCO3-+H+═CO2↑+H2O;Al(OH)3+3H+═Al3++3H2O.
点评 本题考查氧化还原反应及离子方程式书写,为高频考点,明确元素化合价变化与基本概念、离子方程式书写规则是解本题关键,注意氢氧化铝的两性,题目难度不大.


科目:高中化学 来源: 题型:解答题
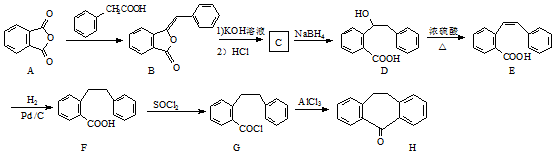
 .
.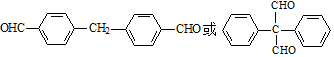 .
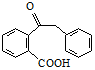
.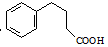 为原料制备
为原料制备 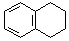 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 | |
| B. | 钢管与电源正极连接,钢管可被保护 | |
| C. | 钢管与铜管露天堆放在一起时,钢管不易被腐蚀 | |
| D. | 钢铁发生析氢腐蚀时,负极反应式:2H+-2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
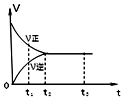
| A. | t1时,只有正方向反应 | |
| B. | t2-t3,反应不再发生 | |
| C. | t2-t3,各物质的浓度均没有发生变化 | |
| D. | t2时,反应到达限度,正反应和逆反应速率相等且等于零 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质粒子直径在1nm~100nm之间 | |
| B. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 光束通过胶体时有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶和滴定管都需要用试剂润洗 | |
| B. | 用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高 | |
| C. | 用滴定管准确量取20.0 mL盐酸 | |
| D. | 用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Ca3(PO4)2 | CaHPO4 | Ca(H2PO4)2 |
| 溶解度(g•L-1) | 2×10-2 | 4.303×10-2 | 18 |
| A. | 含Ca(H2PO4)2的磷肥可以与草木灰混施 | |
| B. | Ksp[CaHPO4]=c(Ca2+)•c(H+)•c(PO43-) | |
| C. | 20℃时,Ca(H2PO4)2饱和溶液物质的量浓度为0.13 mol•L-1 | |
| D. | 向澄清石灰水中逐滴滴入稀磷酸,开始出现浑浊,后变澄清 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
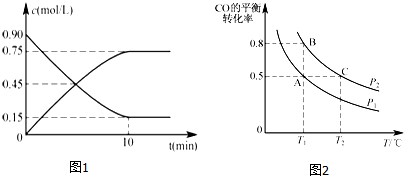 甲醇是一种重要的可再生能源.
甲醇是一种重要的可再生能源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com