
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:

(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
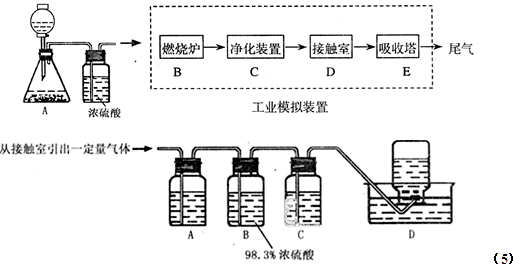
 (2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:
(2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:
| ||
| ||
| ||
| △ |


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| 压强/Mpa 转化率 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 条件改变 | 结论 | |
| A | 平衡后向容器中充入1.0molHe | 平衡逆向移动,化学平衡常数减小 |
| B | 起始时向容器中充入1.0molSO2和0.50molO2 | 达到平衡时共放出78.4kJ的热量 |
| C | 起始时向容器中充入2.0molSO3、0.50mol SO2和0.25mol O2 | 反应达到平衡前v(正)>v(逆) |
| D | 起始时向容器中充入0.025molSO2和0.0125molO2 | 达到平衡时,SO2的转化率为50.0% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com