

分析 接通电源一段时间后,b电极质量增加,应析出金属,则b为阴极,a为阳极,可知M为正极、N为负极,c、e为阳极,d、f阴极,
(1)M为正极,c为阳极,发生氧化反应生成氯气;
(2)由图2可知t1s时乙中1molCl-完全放电,转移1mol电子,e电极上生成的气体为氧气,发生4OH--4e-=2H2O+O2↑,b电极发生Cu2++2e-=Cu;
(3)t2s时,若将直流电源正、负极端对调,a首先析出氢气,然后析出铜.
解答 解:接通电源一段时间后,b电极质量增加,应析出金属,则b为阴极,a为阳极,可知M为正极、N为负极,c、e为阳极,d、f阴极,
(1)M为正极,c为阳极,发生氧化反应生成氯气,电极方程式为2Cl--2e-=Cl2↑,故答案为:正极;2Cl--2e-=Cl2↑;
(2)由图2可知t1s时乙中1molCl-完全放电,转移1mol电子,e电极上生成的气体为氧气,发生4OH--4e-=2H2O+O2↑,生成氧气的物质的量为0.25mol,体积为0.25mol×22.4L/mol=5.6L,b电极发生Cu2++2e-=Cu,生成0.5molCu,质量为0.5mol×64g/mol=32g,则电极b、c的质量差为32g,
故答案为:5.6;32;
(3)t2s时,若将直流电源正、负极端对调,甲电解质溶液为硫酸,a为阴极,首先析出氢气,然后析出铜,电极方程式为:2H++2e-=H2↑、Cu2++2e-=Cu,
故答案为:2H++2e-=H2↑、Cu2++2e-=Cu.
点评 本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
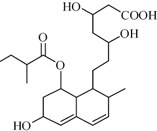 M是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于M的性质描述不正确的是( )
M是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于M的性质描述不正确的是( )| A. | M不能与FeCl3溶液发生显色反应 | |
| B. | 0.1mol M足量的Na反应可产生4.48LH2 | |
| C. | M能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
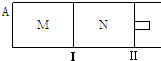
| A. | 若x=2,达到平衡后B 的体积分数关系为:φ(M)>φ(N) | |
| B. | 若x<2,达到平衡后B的转化率关系为:α(M)>α(N) | |
| C. | 若x>2,C的平衡物质的量浓度关系为:c(M)>c(N) | |
| D. | x不论为何值,起始时向N容器中充入任意值的A,平衡后N容器中B的浓度均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4的CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用CH3COOH溶液滴定等物质的量浓度NaOH溶液至pH=7,V(CH3COOH)<V(NaOH)溶液 | |
| C. | 向0.2mol/L的盐酸溶液中加入等体积0.1mol•L-1的NH3•H2O溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
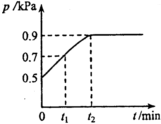 在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.04}{{t}_{1}}$mol(L•min) | |
| B. | 该温度下此反应的平衡常数K=$\frac{0.32}{{t}_{2}}$ | |
| C. | 欲提高平衡体系中Y的含量,可降低体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.10 mol气体X,平衡正向移动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
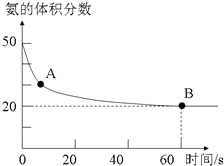 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
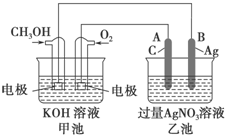 如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com