
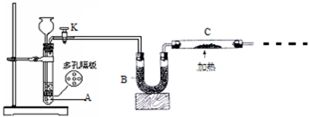
 某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.
某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.
| ||
| ||
| m-n |
| 16 |
| m-n |
| 16 |
| m-n |
| 8 |
| m-n |
| 8 |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
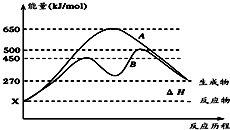 (1)已知:①Fe(s)+
(1)已知:①Fe(s)+| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
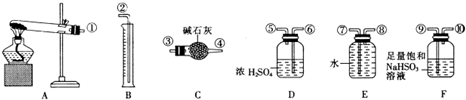
| 实验小组 | 称取硫酸铜的质量(g) | 装置c增加的质量(g) | 量筒中谁的体积折算成标准状况下气体的体积(mL) |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 3.84 | 224 |
查看答案和解析>>
科目:高中化学 来源: 题型:
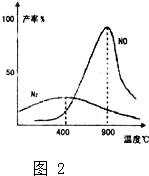
 (1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.
(1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:
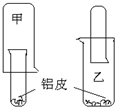 为了适应“低碳生活”,某化学兴趣小组用铝制废牙膏皮、一大一小两种试管和稀硫酸来制取并收集一试管氢气.据此完成下列要求.
为了适应“低碳生活”,某化学兴趣小组用铝制废牙膏皮、一大一小两种试管和稀硫酸来制取并收集一试管氢气.据此完成下列要求.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、等于0.3mol |
| B、等于0.15mol |
| C、小于0.15mol |
| D、大于0.15mol,小于0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol |
| B、1.2 mol |
| C、0.1mol |
| D、1.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
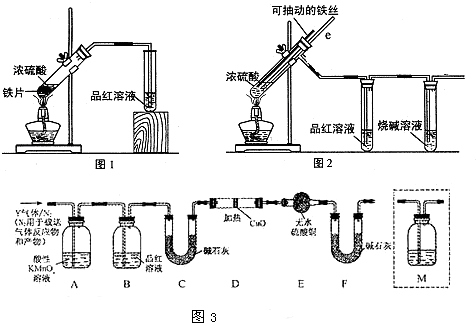
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com