
 ,CS2 分子属于非极性分子(填“极性”或“非极性”).写出一种与 CS2互为等电子体的物质的化学式CO2.
,CS2 分子属于非极性分子(填“极性”或“非极性”).写出一种与 CS2互为等电子体的物质的化学式CO2. 科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.15 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:NaOH>Mg(OH)2 | B. | 热稳定性:HCl>HBr | ||
| C. | 失电子能力:K>Na | D. | 原子半径:CI>S |
查看答案和解析>>
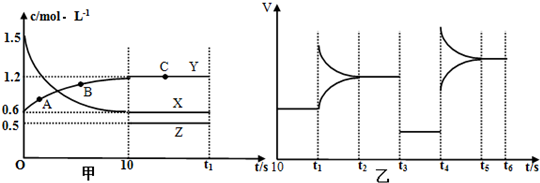
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验某溶液中是否含有Fe3+时,可滴加硫氰化钾溶液,若溶液由无色变为血红色,则说明溶液中一定含有Fe3+ | |
| B. | 稀释浓硫酸时要将水沿烧杯内壁慢慢注入浓硫酸中 | |
| C. | 用CCl4萃取碘水后分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗上口倒出上层液体 | |
| D. | 热的纯碱溶液可用于除油污 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com