
| A. |  | B. |  | C. |  | D. | 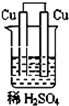 |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去暖瓶内的水垢 | B. | 鸡蛋白溶液遇硝酸变黄 | ||
| C. | 碘单质遇淀粉变蓝 | D. | 用汽油洗去衣物上的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有酸味的柠檬属于酸性食物 | |
| B. | 长期饮用纯净水有益于人体健康 | |
| C. | 长期食用花生油比猪油更有利于健康 | |
| D. | 纯天然物质都是绿色无毒的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为测定某含铝镁合金(不含其它元素)中镁的质量分数,研究性学习小组的三位同学,设计下列三种不同实验方案进行探究.填写下列空白:
为测定某含铝镁合金(不含其它元素)中镁的质量分数,研究性学习小组的三位同学,设计下列三种不同实验方案进行探究.填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体、离子晶体、分子晶体、金属晶体中都一定存在化学键 | |
| B. | 氧化物不可能是还原产物,只可能是氧化产物 | |
| C. | 原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 | |
| D. | 固态导电的一定是金属晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钾和金刚石 | B. | 晶体硅和水晶 | C. | 冰和干冰 | D. | 氯化钠和蔗糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
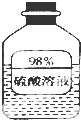 (1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有吸水性.
(1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有吸水性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com