
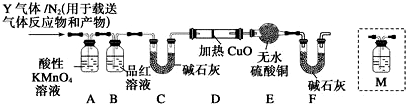
分析 (1)依据浓硫酸的强氧化性解答;
(2)①二价铁离子具有强的还原性,能够使酸性的高锰酸钾褪色,检验Fe2+,可利用+2价亚铁离子能使酸化的高锰酸钾褪色来检验;
②生成的SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,结合关系式:SO2→BaSO4求出SO2的体积分数;
(3)二氧化硫能使品红溶液褪色,从而检验二氧化硫是否除尽;
(4)加热条件下,C和浓硫酸反应生成二氧化碳;
(5)在确定不存在二氧化硫条件下,将气体通入澄清石灰水检验是否含有二氧化碳;
(6)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色.
解答 解:(1)浓硫酸具有强的氧化性,常温下遇到铁发生钝化,形成致密氧化膜阻止反应进行;
故答案为:常温下浓硫酸使铁钝化;
(2)①a.溶液中含有三价铁离子,遇到硫氰酸钾显红色,对二价铁离子检验造成干扰,故a不选;
b.溶液中含有三价铁离子,和NaOH反应生成红褐色沉淀,亚铁离子和NaOH反应生成白色沉淀,但不稳定,立即转化为黄绿色最终转化为红褐色沉淀,所以无论是否含有亚铁离子,加入浓氨水都产生红褐色沉淀,故b不选;
c.亚铁离子和浓氨水反应生成白色沉淀,但不稳定,立即转化为黄绿色最终转化为红褐色沉淀,铁离子和浓氨水反应生成红褐色沉淀,所以无论是否含有亚铁离子,加入浓氨水都产生红褐色沉淀,故c不选;
d.二价铁离子具有强的还原性,能够使酸性的高锰酸钾褪色,三价铁离子不具有还原性,不能使高锰酸钾褪色,所以可以用来检验二价铁离子,故d选;
故选:d;
②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,$\frac{0.336L}{22.4L/mol}$
n(混合气体)═0.015mol,
SO2 →BaSO4
1mol 233g
n 2.33g
n=0.01mol;
则 SO2的体积分数:$\frac{0.01}{0.015}$×100%=66.7%,
故答案为:66.7%;
(3)A除去二氧化硫,二氧化硫能使品红溶液褪色,所以B可以检验A中是否完全除去二氧化硫,
故答案为:检验SO2是否除尽;
(4)加热条件下,C和浓硫酸反应生成二氧化碳,所以Q是二氧化碳,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(5)实验室用澄清石灰水检验二氧化碳,但二氧化硫也能使澄清石灰水变浑浊,要检验二氧化碳应该排除二氧化硫的干扰,所以在确定不存在二氧化硫条件下,将气体通入澄清石灰水检验是否含有二氧化碳,该检验装置应该在B-C之间,
故选c,
故答案为:c;
(6)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色,这是检验水的特征反应,所以如果D中氧化铜变红,E中无水硫酸铜变蓝,则证明含有氢气,
故答案为:D中黑色粉末变红,E中白色粉末变蓝.
点评 本题综合考查元素化合物知识,考查性质实验方案设计,熟悉相关物质的性质是解题关键,注意二价铁离子、三价铁离子的检验方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p3 Y:2s22p4 | ||
| C. | X:3s23p1 Y:2s22p4 | D. | X:3s2 Y:2s22p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质均属于天然高分子化合物,水解产物都只有一种 | |
| B. | 油脂在碱性条件下水解属于皂化反应,酸性条件下的水解产物为甘油和高级脂肪酸 | |
| C. | 用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 | |
| D. | TiCl4+(x+2)H2O$\stackrel{△}{?}$TiO2•xH2O↓+4HCl 属于水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 相对分子质量 | 密度(g/mL) | 沸点(℃) | 水中 溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 沸点:CH3OCH3>CH3CH2OH | D. | 热稳定性:HF>H2O>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 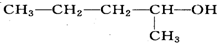 的名称是1-甲基-1-丁醇 的名称是1-甲基-1-丁醇 | |
| B. | 食醋中含有乙酸,乙酸可由乙醇或乙醛氧化得到 | |
| C. | 1mol 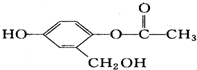 最多能与4molNaOH溶液反应 最多能与4molNaOH溶液反应 | |
| D. | 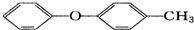 的同分异构体中有醇、酚、脂等类别 的同分异构体中有醇、酚、脂等类别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的甲酸溶液中c(H+)约为0.01mol/L | |
| B. | 甲酸与水以任意比例互溶 | |
| C. | 10mL 1mol/L的甲酸溶液恰好与10mL 1mol/L的NaOH溶液完全反应 | |
| D. | 在相同温度下,物质的量浓度相同的甲酸导电性比硫酸弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com