
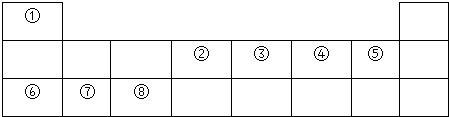
 .
. .
. ,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是
,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是 ,其晶体类型属于离子晶体.
,其晶体类型属于离子晶体.分析 由元素在周期表的位置可知,①~⑧分别为H、C、N、O、F、Na、Mg、Al,
(1)金属性最强的元素为Na;
(2)元素⑧为Al,原子结构中有3个电子层,各层电子数分别为2、8、3;
(3)⑤与⑦形成的常见化合物为MgF2,只含离子键;
(4)②与④形成的三原子分子为CO2;④与⑥形成的原子个数比为1:1的化合物为Na2O2;
(5)电子层越多,原子半径越大;同周期从左向右原子半径减小.
解答 解:由元素在周期表的位置可知,①~⑧分别为H、C、N、O、F、Na、Mg、Al,
(1)金属性最强的元素为Na,位于周期表中第三周期IA族,故答案为:三;IA;
(2)元素⑧为Al,原子结构中有3个电子层,各层电子数分别为2、8、3,则Al的原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)⑤与⑦形成的常见化合物为MgF2,只含离子键,电子式表示该化合物的形成过程为 ,
,
故答案为:离子键; ;
;
(4)②与④形成的三原子分子为CO2,电子式为 ,由分子构成,属于分子晶体;④与⑥形成的原子个数比为1:1的化合物为Na2O2,电子式为
,由分子构成,属于分子晶体;④与⑥形成的原子个数比为1:1的化合物为Na2O2,电子式为 ,含离子键、共价键,属于离子晶体,
,含离子键、共价键,属于离子晶体,
故答案为: ;分子晶体;
;分子晶体; ;离子晶体;
;离子晶体;
(5)电子层越多,原子半径越大;同周期从左向右原子半径减小,则①、②、③、⑥、⑦中,原子半径由大到小的顺序是⑥>⑦>②>③>①,
故答案为:⑥>⑦>②>③>①.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识、元素周期律为解答的关键,侧重分析与应用能力的考查,注意化学用语及规律性知识的使用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氧化性:MnO4-<Cl2<Fe3+<I2 | |
| B. | 还原性:Fe2+>I->Cl- | |
| C. | FeCl3能使湿润的淀粉碘化钾试纸变蓝 | |
| D. | 反应①中只体现盐酸的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL0.1mol/LKCl溶液 | B. | 200mL0.10mol/LNaCl溶液 | ||
| C. | 200 mL 0.10mol/LBaCl2溶液 | D. | 100mL0.1mol/LAl2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
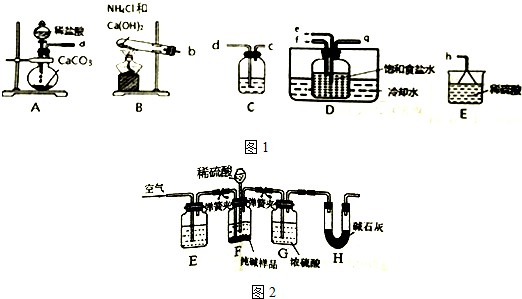
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
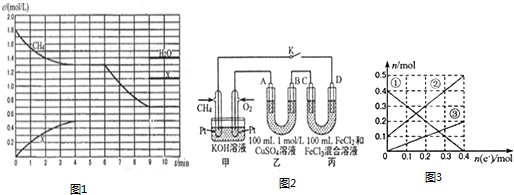
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
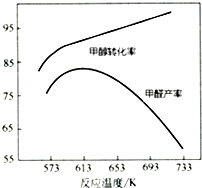 Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).| 物质 | 反应热/kJ•mol-1 |
| CH3OH (g) | -726.5 |
| HCHO (g) | -570.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
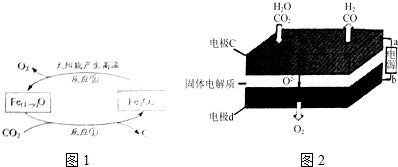
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
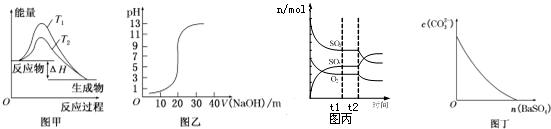
| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00ml 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| D. | 图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)浓度变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com