
|
��˹������Ϊ�����ܻ�ѧ������һ����ɻ��Ϊ������ɣ�������̵���ЧӦ����ͬ�ģ���֪��H2O(g)��H2O(l) ��H1����Q1kJ��mol��1 C2H5OH(g)��C2H5OH(l)��H2����Q2kJ��mol��1 C2H5OH(g)+3O2(g)��2CO2(g)+3H2O(g)��H3����Q3kJ��mol��1 ��ʹ23 g�ƾ�Һ����ȫȼ�գ����ָ������£���ų�������Ϊ(KJ) | |
| [����] | |
A�� |
Q1+O2+Q3 |
B�� |
0.5(Q1+Q2+Q3) |
C�� |
0.5Q1��1.5O2+0.5Q3 |
D�� |
1.5Q1��0.5O2+0.5Q3 |
 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д� Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
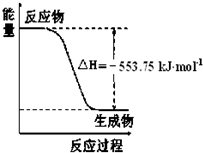 ��1����˹������Ϊ�����ܻ�ѧ������һ����ɻ��������ɣ��������̵���
��1����˹������Ϊ�����ܻ�ѧ������һ����ɻ��������ɣ��������̵����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Q1+Q2+Q3 | B��0.5��Q1+Q2+Q3�� | C��0.5 Q1-1.5 Q2+0.5Q3 | D��1.5 Q1-0.5 Q2+0.5Q3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ�ϲ����и߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��12�֣���1����˹������Ϊ�����ܻ�ѧ������һ����ɻ��������ɣ��������̵�����ЧӦ��ͬ�������ø�˹���ɻش��������⣺
��֪�� C2H5OH(g)��3O2(g)=2CO2(g)��3H2O(g)����H1����Q1 kJ/mol��C2H5OH(g)=C2H5OH
(l)����H2����Q2 kJ/mol��H2O(g)=H2O(l)����H3����Q3 kJ/mol����ʹ23gҺ̬��ˮ�ƾ���ȫ
ȼ�գ����ָ������£������������зų�������Ϊ ________________ kJ��
��2���������˻����ƻ�潫�й���ͳ�Ļ������˾����Լ��ִ��߿Ƽ���Ϊһ�塣�����
���ܴ����Դ�ڱ����ȼ�գ�������һ��������ȼ�ϡ��Իش��������⣺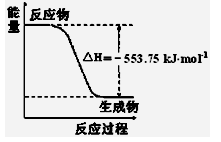
����ͼ��һ����������ȫȼ������CO2��1mol H2O(l)�����е������仯ͼ����д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ ��
�ڽ������Ѿ����Ƴ�����ȼ�ϵ�أ��õ�صĵ������ҺΪKOH��Һ��д���õ�ظ����ĵ缫��Ӧʽ��__________________________________________��
��ij���������ԭ������Ϊ52.00,��������ص��ý�����һ�ֺ������ε�����ˮ��Һʱ������ÿ�ų� 3360ml����״���������壬������������ 10.4 g���ڸú��������н����Ļ��ϼ�Ϊ ____ ���ڸ�ʵ���У�����������������ʧ����������ı�������������� __ g�������ȷ��0.01 g����?
�ܶ����ѣ�CH3OCH3����һ������ȼ�ϣ�Ӧ��ǰ��������1mol��������ȫȼ������CO2��Һ̬ˮ�ų�1455kJ��������1mol����Ͷ����ѵĻ��������ȫȼ������CO2��Һ̬ˮ���ų�1645kJ���������������У�����Ͷ����ѵ����ʵ���֮��Ϊ ____ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��߿���ѧ����ר���̵�5�� ��ѧ��Ӧ��������ϰ���������棩 ���ͣ������
��1��2012���ذ��˻�����ñ���Ϊȼ�ϡ�������ֵ�ϸߣ���Ⱦ��С����һ��������ȼ�ϡ��Իش��������⣺

����ͼ��һ����������ȫȼ������CO2��1 mol H2O(l)�����е������仯ͼ������ͼ�е���������������������������
��д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��___________________________________��
��������(CH3OCH3)��һ������ȼ�ϣ�Ӧ��ǰ��������1 mol��������ȫȼ������CO2��Һ̬ˮ�ų�1 455 kJ��������1 mol����Ͷ����ѵĻ��������ȫȼ������CO2��Һ̬ˮ���ų�1 645 kJ���������������У�����Ͷ����ѵ����ʵ���֮��Ϊ________��
��2����˹������Ϊ�����ܻ�ѧ������һ����ɻ�ּ�����ɣ��������̵�����ЧӦ��ͬ�������ø�˹���ɻش��������⣺
����֪��H2O(g)=H2O(l)����H1����Q1 kJ/mol C2H5OH(g)=C2H5OH(l)����H����Q2 kJ/mol
C2H5OH(g)��3O2(g)=2CO2(g)��3H2O(g)����H3����Q3 kJ/mol
��ʹ46 gҺ̬��ˮ�ƾ���ȫȼ�գ����ָ������£������������зų�������Ϊ________kJ��
��̼(s)��������Ӧ������ʱ������COͬʱ����������CO2�������ͨ��ʵ��ֱ�Ӳ�÷�Ӧ�� C(s)�� O2(g)=CO(g)����H���������ʵ�顢���ø�˹���ɼ�����÷�Ӧ����H������ʱ��Ҫ��õ�ʵ��������________��
O2(g)=CO(g)����H���������ʵ�顢���ø�˹���ɼ�����÷�Ӧ����H������ʱ��Ҫ��õ�ʵ��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ɽ��ʡ�����и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��˹������Ϊ�����ܻ�ѧ������һ����ɻ��Ϊ������ɣ�������̵���ЧӦ����ͬ�ġ�
��֪��H2O��g��=H2O��l����H1 =��Q1kJ/mol
C2H5OH��g��=C2H5OH��l�� ��H2 =��Q2kJ/mol
C2H5OH��g��+3O2��g��=2CO2��g��+3H2O��g�� ��H3 =��Q3kJ/mol
��ʹ0��5mol�Ҵ�Һ����ȫȼ�գ����ָ������£���ų�������Ϊ��kJ��
A��Q1+Q2+Q3
B��0��5��Q1+Q2+Q3��
C��0��5 Q2��1��5 Q1��0��5Q3
D��1��5 Q1��0��5 Q2+0��5Q3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com