

 �ɵ�N2��g��+O2��g��?2NO��g�����ʡ�H=
�ɵ�N2��g��+O2��g��?2NO��g�����ʡ�H= ×[��-905kJ/mol��-��-1258kJ/mol��]=+181.5 kJ/mol��
×[��-905kJ/mol��-��-1258kJ/mol��]=+181.5 kJ/mol��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�콭��ʡ�����и߶���ѧ����ĩ���в��Ի�ѧ�Ծ��������棩 ���ͣ������
���Ṥҵ�Ļ����ǰ��Ĵ��������ڴ��������·������·�Ӧ��
�� 4NH3(g)+5O2(g)  4NO(g)+6H2O(g)
��H = ��905
kJ/mol ������Ӧ
4NO(g)+6H2O(g)
��H = ��905
kJ/mol ������Ӧ
�� 4NH3(g)+3O2(g)  2N2(g)+6H2O(g) ��H = ��1268 kJ/mol �ڸ���Ӧ
2N2(g)+6H2O(g) ��H = ��1268 kJ/mol �ڸ���Ӧ
�й����ʲ������¶ȵĹ�ϵ���ͼ��
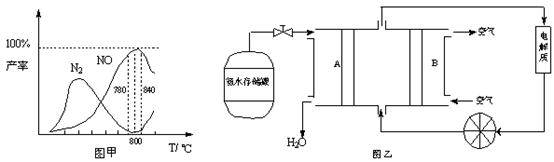
��1���ɷ�Ӧ�٢ڿ�֪��Ӧ��N2(g) + O2(g)  2NO(g)�ķ�Ӧ�Ȧ�H=
2NO(g)�ķ�Ӧ�Ȧ�H=
��2����ͼ��֪��ҵ�ϰ����������� NOʱ����Ӧ�¶���ÿ�����
��3����Fe3O4�Ʊ�Fe��NO3��3��Һʱ����ӹ�����ϡ���ᣬԭ��һ����Fe4O3�е�Fe2+ȫ��ת��ΪFe3+��
ԭ����� �������ֺ����ӷ���ʽ˵������
��4����NH3ͨ��NaClO��Һ�У�������N2H4����Ӧ�����ӷ���ʽΪ ��
��5�����ݷ�Ӧ�ڿ�����Ƴ�ֱ�ӹ���ʽ����ȼ�ϵ�أ�����ͼ��ʾ������ͼ��AΪ ��������������������缫����ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�콭��ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
���Ṥҵ�Ļ����ǰ��Ĵ��������ڴ��������·������·�Ӧ��
�� 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ��H =
��905 kJ/mol ������Ӧ
4NO(g)+6H2O(g) ��H =
��905 kJ/mol ������Ӧ
�� 4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
��H = ��1268 kJ/mol �ڸ���Ӧ
2N2(g)+6H2O(g)
��H = ��1268 kJ/mol �ڸ���Ӧ
�й����ʲ������¶ȵĹ�ϵ���ͼ��
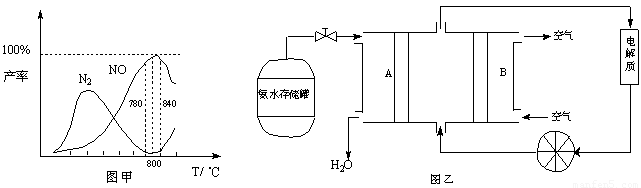
��1���ɷ�Ӧ�٢ڿ�֪��Ӧ��N2(g) + O2(g) 2NO(g)�ķ�Ӧ�Ȧ�H= ��
2NO(g)�ķ�Ӧ�Ȧ�H= ��
��2����ͼ��֪��ҵ�ϰ����������� NOʱ����Ӧ�¶���ÿ����� ��
��3����Fe3O4�Ʊ�Fe��NO3��3��Һʱ����ӹ�����ϡ���ᣬԭ��һ����Fe4O3�е�Fe2+ȫ��ת��ΪFe3+��
ԭ����� �������ֺ����ӷ���ʽ˵������
��4����NH3ͨ��NaClO��Һ�У�������N2H4����Ӧ�����ӷ���ʽΪ ��
��5�����ݷ�Ӧ�ڿ�����Ƴ�ֱ�ӹ���ʽ����ȼ�ϵ�أ�����ͼ��ʾ������ͼ��AΪ ��������������������缫����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���Ṥҵ�Ļ����ǰ��Ĵ��������ڴ��������·������·�Ӧ��
�� 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ��H = ��905 kJ/mol ������Ӧ
4NO(g)+6H2O(g) ��H = ��905 kJ/mol ������Ӧ
�� 4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ��H = ��1268 kJ/mol �ڸ���Ӧ
2N2(g)+6H2O(g) ��H = ��1268 kJ/mol �ڸ���Ӧ
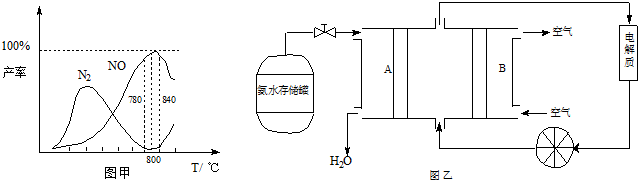
�й����ʲ������¶ȵĹ�ϵ���ͼ��
 |
��1���ɷ�Ӧ�٢ڿ�֪��Ӧ��N2(g) + O2(g) ![]() 2NO(g)�ķ�Ӧ�Ȧ�H= ��
2NO(g)�ķ�Ӧ�Ȧ�H= ��
��2����ͼ��֪��ҵ�ϰ����������� NOʱ����Ӧ�¶���ÿ����� ��
��3����Fe3O4�Ʊ�Fe��NO3��3��Һʱ����ӹ�����ϡ���ᣬԭ��һ����Fe4O3�е�Fe2+ȫ��ת��ΪFe3+��
ԭ����� �� �������ֺ����ӷ���ʽ˵������
��4����NH3ͨ��NaClO��Һ�У�������N2H4����Ӧ�����ӷ���ʽΪ �� ��
��5�����ݷ�Ӧ�ڿ�����Ƴ�ֱ�ӹ���ʽ����ȼ�ϵ�أ�����ͼ��ʾ������ͼ��AΪ �� ��������������������缫����ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com