
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 次氯酸 | Ka1=2.98×10-8 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
分析 一般来说,电离平衡常数越大,酸的电离程度越大,则酸性越强,由题给数据可知酸性H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCO3-,强酸可与弱酸的盐反应制备弱酸,注意HClO的强氧化性的特点,以此解答该题.
解答 解:(1)由题给数据可知酸性H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCO3-,而酸性越弱,则对应的盐水解程度越大,溶液中H+浓度越小,酸性越强,对应的盐水解程度越小,则H+浓度越大,所以六种盐溶液中c(H+)的大小得顺序为NaHSO3>CH3COONa>NaHCO3>Na2SO3>NaClO>Na2CO3,
故答案为:NaHSO3>CH3COONa>NaHCO3>Na2SO3>NaClO>Na2CO3;
(2)因酸性H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCO3-,则往六种盐溶液中分别通入少量SO2,能发生反应的为CH3COONa、NaHCO3、Na2CO3、Na2SO3,因HClO具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应,反应的化学方程式依次为SO2+H2O+2CH3COONa=2CH3COOH+Na2SO3、SO2+H2O+3NaClO=Na2SO3+2HClO+NaCl、SO2+2NaHCO3=Na2SO3+2CO2↑+H2O、SO2+H2O+Na2CO3=NaHCO3+NaHSO3、SO2+H2O+Na2SO3=2NaHSO3,
故答案为:SO2+H2O+2CH3COONa=2CH3COOH+Na2SO3、SO2+H2O+3NaClO=Na2SO3+2HClO+NaCl、SO2+2NaHCO3=Na2SO3+2CO2↑+H2O、SO2+H2O+Na2CO3=NaHCO3+NaHSO3、SO2+H2O+Na2SO3=2NaHSO3.
点评 本题考查了电解质的电离,为高频考点,侧重学生的分析的考查,注意把握电离常数与酸性强弱的判断,把握强酸与弱酸盐反应的特点,为解答该题的关键,二氧化硫与次氯酸钠的反应为易错点,难度中等.


科目:高中化学 来源: 题型:解答题
| A | 完全燃烧的产物中n(CO2):n(H2O)=2:1 28<Mr(A)<60 不能使溴的四氯化碳溶液褪色 一氯代物只有1种结构 |
| B | 饱和链烃,通常情况下呈气态 二溴代物有3种 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
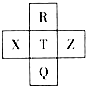 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:R>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
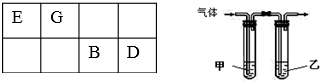
 .
.| 实验编号 | X物质的量浓度(mol•L-1) | Y物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
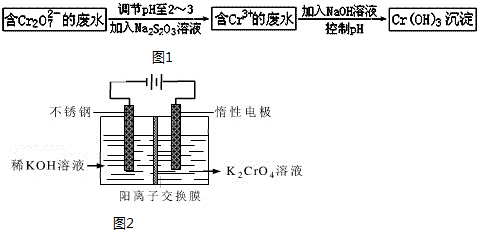
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国2015年玉月1日正式实施的《环境保护法》被称为“史上最严”环保法,为保护好环境,工业生产应从源头上减少或尽量消除生产对环境的污染 | |
| B. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯 等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| C. | 世界卫生组织认为青蒿素(结构如右图所示)联合疗法是当下治疗疟疾最 有效的手段,已经拯救了上百万生命,靑蒿素属于烃类物质 | |
| D. | 某品牌化妆品在广告中反复强调:“十年专注自然护肤”,该产品中不含任何化学成分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com