
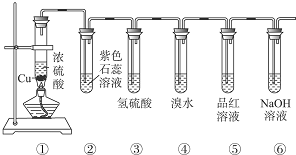
 实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.分析 二氧化硫是否存在可用品红溶液检验;检验乙烯可以用溴水或高锰酸钾酸性溶液;
乙烯和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色;
乙烯与溴水发生加成反应使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br,乙烯被酸性高锰酸钾氧化使其褪色;
二氧化硫与溴水、酸性高锰酸钾发生氧化还原反应,5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4,SO2+Br2+H2O═H2SO4+2HBr;乙烯不与NaOH溶液反应,但二氧化硫能与碱反应(SO2+2NaOH=Na2SO3+H2O),故乙烯的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在;再通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净;最后用高锰酸钾酸性溶液褪色实验检验乙烯;
实验室利用乙醇能发生消去反应制乙烯.
解答 解:(1)乙烯不与NaOH溶液反应,但二氧化硫能与碱反应(SO2+2NaOH=Na2SO3+H2O),二氧化硫是否存在可用品红溶液检验.乙烯的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在;再通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净.最后用高锰酸钾酸性溶液褪色实验检验乙烯,
故答案为:A;B;A;D;
(2)二氧化硫是否存在可用品红溶液检验,品红溶液褪色说明含有二氧化硫,故答案为:装置Ⅰ中品红溶液褪色;
(3)乙烯和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色,二氧化硫的存在影响乙烯的检验,故检验乙烯时应先除去二氧化硫,
故答案为:除去二氧化硫气体,以免干扰乙烯的实验;
(4)通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,故答案为:检查二氧化硫是否除尽;
(5)最后用高锰酸钾酸性溶液褪色实验检验乙烯,装置Ⅳ中的酸性高锰酸钾溶液褪色,说明含有乙烯,故答案为:装置Ⅲ中的品红溶液不褪色,装置Ⅳ中的酸性高锰酸钾溶液褪色;
(6)实验室利用乙醇能发生消去反应制乙烯,反应为CH3-CH2-OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,故答案为:CH3-CH2-OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
点评 本题主要考查乙烯的化学性质、乙烯的制备以及常见气体的检验,还涉及化学反应方程式的正确书写,题目难度不大,注意实验的先后顺序.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子核都是由质子和中子构成 | |
| B. | 质子数相同的粒子其化学性质不一定相同 | |
| C. | 某种粒子最外层上有8个电子,则一定是稀有气体元素的原子 | |
| D. | 原子电子构型为ns2np6的为稀有气体元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
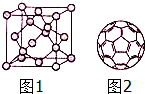 碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义.
碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义.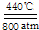 2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).
2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中滴加足量氨水 | |
| B. | 向酚酞试液中通入过量Cl2 | |
| C. | 向紫色石蕊试液中通入过量SO2 | |
| D. | 向酚酞试液中加入Na2O2粉末至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验.
某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验.| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | BaSO4 | BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
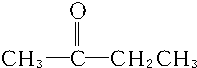 C:CH2═CH-CH2CH3或CH3CH═CH-CH3.
C:CH2═CH-CH2CH3或CH3CH═CH-CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com