
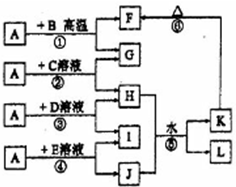
 ��ͼ��ʾ��A��G��I��Ϊ���ʣ�����A��GΪ�����Ҷ�����������絼�߲��ϣ�BΪ��ɫ��ĩ��L��������Ԫ����ɵ��Σ����Ǽ�ͥ�����ر���Ʒ����ش�
��ͼ��ʾ��A��G��I��Ϊ���ʣ�����A��GΪ�����Ҷ�����������絼�߲��ϣ�BΪ��ɫ��ĩ��L��������Ԫ����ɵ��Σ����Ǽ�ͥ�����ر���Ʒ����ش�

 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ҫ��ȥ���еı��ӣ�����NaOH��Һ�����Ȼ���Һ |
| B����װ��Fe��NO3��2��Һ���Թ��м���ϡH2SO4���ڹܿڹ۲쵽����ɫ��������˵����Һ�еķ�Ӧ������NO2 |
| C���������Һ�м���ϡH2SO4�����ȼ����ӣ���ȴ���ټ�������Cu��OH��2��Һ�����ȣ�û�к�ɫ�������ɣ�˵������û��ˮ��������� |
| D����ͬ�¶��£�ȡ���ݵ�������п���ֱ�������ϡ���ᷴӦ��������һ���м��뼸��CuSO4��Һ������CuSO4��Һ�IJ��������죬���ն�����������������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������Ũ���������������ۻ������ڳ�����������������������Ũ���� |
| B���������ᴿ�����ʲ��������������� |
| C���������費���κ��ᷴӦ������ʯӢ������������ |
| D��п�Ľ��������Ա�����ǿ�����ں��������װ����п���Լ����丯ʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������A | B������B |
| C������C | D������D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ʡ���ά�ء����ǡ���Ȼ�����۶��Ǹ߷��ӻ����� |
| B����ϩ�ͱ�����ʹ��ˮ��ɫ����ɫ��ԭ����ͬ |
| C�����ۡ������ǡ�֬���͵�������һ�������¶��ܷ���ˮ�ⷴӦ |
| D���Ʊ���Ĺ����漰��������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ø������ɫʯ����ֽ |
| B���ø�����ɫ���� |
| C��������ͨ��AgNO3��Һ |
| D����ʪ��ĵ��۵⻯����ֽ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������Ľ�����ֽ��Ʒ�������ǿɻ�����Դ���������ǿɻ�����Դ |
| B�������ƹ�ũ�����������μ������Լ���ũҩ��ʹ�� |
| C�����������������ȼú����������β����������������߿������� |
| D������̼������������к��������������ٴӶ�����CO2�ŷ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
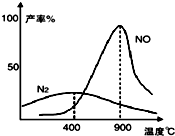 ������������145��Ϳ�ʼ��Ӧ���ڲ�ͬ�¶Ⱥʹ������������ɲ�ͬ�����ͼ����
������������145��Ϳ�ʼ��Ӧ���ڲ�ͬ�¶Ⱥʹ������������ɲ�ͬ�����ͼ�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com