
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
| A、铁是人类在生产、生活中最早使用的金属 |
| B、金、银、铜是应用最广泛的金属材料 |
| C、钛被誉为“21世纪的金属”,应用前景很广阔 |
| D、铜是导电性、导热性最好的黑色金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe、Cu、Al、Na、Mg |
| B、Mg、Cu、Al、Na、Fe |
| C、Al、Cu、Mg、Na、Fe |
| D、Mg、Na、Al、Cu、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
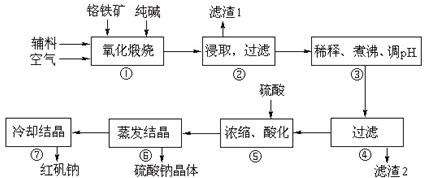
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | 0℃ | 40℃ | 80℃ |
| KCl | 28.0 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38.0 |
| K2Cr2O7 | 4.7 | 26.3 | 73.0 |
| Na2Cr2O7 | 163.0 | 215.0 | 376.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B、硬度由大到小:金刚石>碳化硅>晶体硅 |
| C、熔点由高到低:Na>Mg>Al |
| D、熔点由高到低:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com