
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是( )
A.过量的铁在1molCl2中然烧,最终转移电子数为2NA
B.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为6NA
C.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D.1L1mol/LNaF溶液中F-的数目为NA
【答案】D
【解析】
A.铁过量,氯气反应完,由![]() 可知,1molCl2反应,转移电子数为2NA,A正确;
可知,1molCl2反应,转移电子数为2NA,A正确;
B.m(乙醇)=50g×46%,n(乙醇)=![]() =0.5mol,乙醇(C2H5OH)中H的物质的量=0.5mol×6=3mol,该溶液中,溶剂水也含H原子,m(水)=50g×(1-46%),n(H2O)=
=0.5mol,乙醇(C2H5OH)中H的物质的量=0.5mol×6=3mol,该溶液中,溶剂水也含H原子,m(水)=50g×(1-46%),n(H2O)=![]() =1.5mol,水中H原子物质的量=1.5mol×2=3mol,所以H原子总物质的量=3mol+3mol=6mol,故在50g质量分数为46%的乙醇水溶液中,含氢原子总数为6NA,B正确;
=1.5mol,水中H原子物质的量=1.5mol×2=3mol,所以H原子总物质的量=3mol+3mol=6mol,故在50g质量分数为46%的乙醇水溶液中,含氢原子总数为6NA,B正确;
C.反应中部分硝酸根中N元素由+5价降低为氮气中0价,铵根中N元素3价升高为氮气中0价,氮气既是还原产物又是氧化产物,由氮原子守恒,结合方程式可知,还原产物与氧化产物物质的量之比为3:5,生成氮气物质的量=![]() =1mol,故氧化产物的物质的量为1mol×
=1mol,故氧化产物的物质的量为1mol×![]() =
=![]() mol,铵根中N元素被氧化,故转移电子为
mol,铵根中N元素被氧化,故转移电子为![]() mol×2×[0(3)]=3.75mol,个数为3.75NA,C正确;
mol×2×[0(3)]=3.75mol,个数为3.75NA,C正确;
D.n(NaF)= 1mol/L×1L=1mol,因F-会水解,n(F-)﹤1mol,F-的数目小于NA,D错误。
答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】治疗帕金森病的新药沙芬酰胺的合成方法如下:

已知:
①CH3CN 在酸性条件下可水解生成 CH3COOH。
②CH2=CH-OH 和 CH3OOH 均不稳定。
(1)C 生成 D 的反应类型为_______________。G中含氧官能团的名称为_____。B 的名称为_____。
(2)沙芬酰胺的结构简式为_____。
(3)写出反应(1)的方程式_____。分析反应(2)的特点,写出用福尔马林浸制生物标本的反应原理的方程式_____(蛋白质的结构用![]() 表示)。
表示)。
(4)H 是 F 相邻的同系物,H 的苯环上有两个处于对位的取代基,符合下列条件的 H 的稳定的同分异构体共有_____种。
①苯环上仍然有两个处于对位的取代基;
②能与 NaOH 溶液反应;
(5)下图是根据题中信息设计的由丙烯为起始原料制备 B 的合成路线,在方框中补全必要的试剂和中间产物的结构简式(无机试剂任选,氧化剂用[O]表示,还原剂用[H]表示,连 续氧化或连续还原的只写一步)。________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中加入浓度均为0.2 mol·L1的CO和H2O, T℃发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
A.单位时间内消耗1 mol CO同时生成1 mol CO2
B.混合气体的密度不再变化
C.CO、H2O、CO2和H2 的浓度不再变化
D.混合气体的平均摩尔质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氢氧燃料电池是符合绿色化学理念的新型发电装置,如图1为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
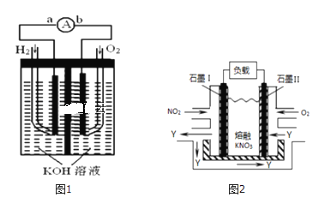
(1)负极反应式为______.
(2)电极表面镀铂粉的原因为______.
II.分析下列电解过程:
(1)写出惰性电极电解CuSO4溶液的总反应的离子方程式:______;
(2)写出惰性电极电解NaCl溶液的阳极反应式______;电解一段时间后加______(填物质名称)恢复电解前状况.
III.NO2、O2和熔融KNO3可制作燃料电池,其原理如图2
(1)请写出负极的电极方程式:______.
(2)相同条件下,放电过程中消耗的NO2和O2的体积比为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨广泛用于冶金、机械、建筑、电子等领域。以黑钨精矿为原料冶炼钨的流程如图所示:
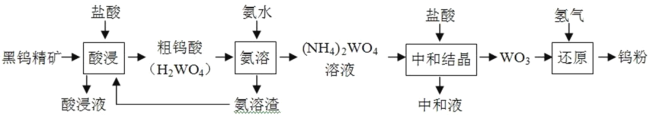
请回答下列问题。
(1)“酸浸液”中含有 Fe3+、Fe2+等金属离子,检验其中的 Fe2+常使用铁氰化钾溶液,反应的离子方程式 为_____。
(2)“氨溶”时需加热,但应控制温度不超过 70℃的原因为_____。
(3)“中和结晶”时(NH4)2WO4 与盐酸反应生成 WO3 的化学方程式为_____,所得“中和 液”的主要溶质的电子式为_____。
(4)流程图中设计将“氨溶渣”返回“酸浸”过程的目的为__________。
(5)钨钛合金在工业中应用广泛, NH4Fe(SO4)2 滴定法可测定合金中钛的含量:称取 w g 钨钛合金,用 HNO3-HF混合液溶解,用 NaOH 溶液沉淀并分离钛元素后加盐酸溶解,用金属铝将 Ti4+还原为 Ti3+,向溶液中加几滴 KSCN 作指示剂,用 c mol/L 的 NH4Fe(SO4)2 标准溶液滴定至溶液显红色,消耗标准溶液的体积为 V mL。
①滴定时发生反应的离子方程式是_____;
②样品中钛的含量为_____%(用含 w、c、V 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】斑蝥黄是一种有机颜料,其结构如图所示,下列说法正确的是

A.斑蝥黄的分子式为 C40H50O2
B.斑蝥黄的一氯代物可能存在 13 种结构(不考虑立体异构)
C.斑蝥黄能发生加成反应和酯化反应
D.斑蝥黄易溶于水和有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1mol·L-1氨水中滴入0.1mol·L-1盐酸,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加盐酸体积的关系如图所示,下列说法不正确的是( )
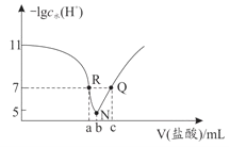
A.常温下,Kb(NH3·H2O)约为1×10-5
B.b=20.00
C.R、Q两点对应溶液均呈中性
D.R到N、N到Q所加盐酸体积不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正溴丁烷是稀有元素萃取的溶剂及有机合成的中间体,其制备如图(夹持装置略):
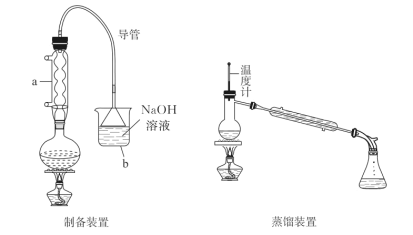
已知:i.NaBr+H2SO4(浓)=HBr↑+NaHSO4
ii.CH3CH2CH2CH2OH十HBr→CH3CH2CH2CH2Br+H2O
iii.2HBr+H2SO4![]() Br2+SO2+2H2O
Br2+SO2+2H2O
iv.正溴丁烷密度:1.27g·mL-1;浓硫酸密度:1.84g·mL-1
请回答下列问题:
(1)正溴丁烷粗产品的制备:
①仪器a的名称是__,向圆底烧瓶中添加药品顺序正确的是__(填正确选项字母)。
A.浓H2SO4→适量水→正丁醇→溴化钠粉末
B.适量水→浓H2SO4→正丁醇→溴化钠粉末
C.适量水→正丁醇→浓H2SO4→溴化钠粉末
D.适量水→正丁醇→溴化钠粉末→浓H2SO4
②装置b中装入NaOH溶液,目的是__。
③加热回流,在此期间要不断地摇动反应装置,其原因为__;冷却后改为蒸馏装置,蒸出其正溴丁烷的粗品。
(2)正溴丁烷的提纯:
①把正溴丁烷粗品倒入分液漏斗中,加入适量水洗涤,分出有机层;
②在另一干燥的分液漏斗中,加入浓硫酸洗去有机层中少量的未反应的正丁醇及副产物,从__(选填“上口”或“下口”)分出有机层;
③有机层依次用适量的水、浓硫酸、水、饱和NaHCO3溶液、水洗涤,用无水CaCl2干燥。以上三次用水洗涤简化为一次用水洗涤是否合理,并说明理由__。
(3)①若洗涤后产物有红色,说明含有溴单质,应加入适量的饱和NaHSO3溶液洗涤,将溴单质全部除去,其反应的离子方程式为__。
②若投入正丁醇11.84g,得到产物12.50g。则正丁醇的转化率为__(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象与氢键有关的是( )
①![]() 的熔、沸点比
的熔、沸点比![]() 的高
的高
②乙醇能与水以任意比混溶,而乙硫醇(![]() )微溶于水
)微溶于水
③冰的密度比液态水的密度小
④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑤![]() 比
比![]() 稳定
稳定
⑥接近沸点的水蒸气的相对分子质量测量值大于实际值
A.①②③④⑥B.①②③④⑤C.②③④⑤D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com