
| A. | 5.6 g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023 | |
| B. | 反应MgCl2(s)═Mg(s)+Cl2(g)的△H<0、△S>0 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| D. | 0.1 mol•L-1 Na2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HS${o}_{3}^{-}$) |
分析 A、根据铁与硝酸反应生成物可能是Fe2+或Fe3+离子分析;
B、MgCl2的分解反应属于吸热反应;
C、Ksp与为沉淀溶解平衡常数,只与难溶电解质的性质和温度有关;
D、从物料守恒和电荷守恒两个角度列式比较.
解答 解:A、铁与硝酸反应生成物可能是Fe2+或Fe3+离子,当生成Fe2+离子时,转移的电子数为0.2×6.02×1023,当生成Fe3+离子时,转移的电子数为0.3×6.02×1023,故A错误;
B、MgCl2的分解反应属于吸热反应,△H>0,反应后生成气体,熵变增加,△S>0,故B错误;
C、Ksp与为沉淀溶解平衡常数,只与难溶电解质的性质和温度有关,与溶液中相关离子的浓度无关,故C错误;
D、0.1mol•L-1Na2SO3溶液中,根据物料守恒有:c(Na+)=2c(H2SO3)+2c(HSO3-)+2c(SO32-),根据溶液电中性有:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),则:c(OH-)-c(H+)=c(Na+)-c(HSO3-)-2c(SO32-)=2c(H2SO3)+2c(HSO3-)+2c(SO32-)-c(HSO3-)-2c(SO32-)=2c(H2SO3)+c(HSO3-),故D正确.
故选D.
点评 本题考查离子浓度的大小比较等问题,题目难度较大,本题易错点为D项,注意从溶液中存在的电荷守恒、质子守恒、物料守恒的角度分析.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 水玻璃中加入稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ | |
| B. | 铝与稀硝酸反应:2Al+6H+═2Al3++3H2↑ | |
| C. | 氯化铝溶液和过量氨水反应:Al3++3NH3•H2O═3NH4++Al (OH)3↓ | |
| D. | 向硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Cu,负极为Fe,电解质为FeCl3溶液 | |
| B. | 负极为Fe,正极为C,电解质为Fe(NO3)2溶液 | |
| C. | 正极为Ag,负极为Fe,电解质为Fe2(SO4)3溶液 | |
| D. | 负极为Fe,正极为Pt,电解质为Fe2(SO4 )3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
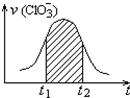 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )| A. | 反应开始时速率增大可能是c(H+)增大引起的 | |
| B. | 纵坐标为v(H+)的速率-时间曲线与图中曲线不能完全重合 | |
| C. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| D. | 图中阴影部分“面积”为t1至t2时间内的ClO3-的物质的量的减小值 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
 ;元素T基态原子的价电子排布式为3s23p5.
;元素T基态原子的价电子排布式为3s23p5.| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物总物质的量 |
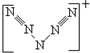 ,其中可能含有4个σ键,4个π键,4对孤电子对.
,其中可能含有4个σ键,4个π键,4对孤电子对.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
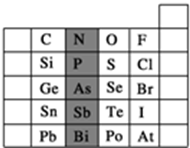 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com