


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、缺碘易患大脖子病 |
| B、聚氯乙烯塑料不可用来包装食品 |
| C、皮肤被烫伤或受浓硝酸腐蚀时,细胞结构将受到破坏 |
| D、由于淀粉在人体中会转化为氨基酸,因此每天都要摄入一定量的淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(C6H12O7)2Ca |
| B、(C6H11O7)2Ca |
| C、(C6H12O6)2Ca |
| D、(C6H12O8)2Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:
 中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
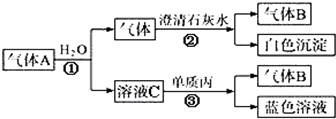
查看答案和解析>>
科目:高中化学 来源: 题型:
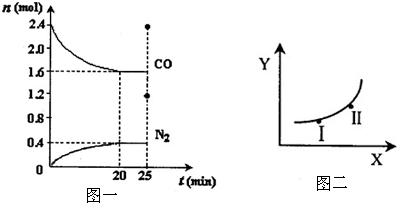
| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2-ls22s22p6 |
| B、S2-ls22s22p6 3s23p44s2 |
C、F  |
D、Na+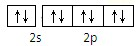 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com