
【题目】下表是元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
⑴①元素的名称:_______,⑧元素的符号:_______;
⑵在这些元素中,最活泼的金属元素的离子结构示意图是____,最活泼的非金属元素是____(填元素符号,下同),____是最不活泼的元素;
⑶这些元素的最高价氧化物对应水化物中,______(填化学式,下同)酸性最强,________碱性最强;能形成两性氢氧化物的元素是____(填元素符号);
⑷在⑤到的元素中,_______(填元素符号)原子半径最小;
⑸⑤和⑦两种元素最高价氧化物对应的水化物相互反应的离子方程式:__________。
【答案】碳 Si 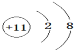 F Ar HClO4 NaOH Al Cl Al(OH)3 + OH- = AlO2- + 2H2O
F Ar HClO4 NaOH Al Cl Al(OH)3 + OH- = AlO2- + 2H2O
【解析】
由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为P、⑩为S、为Cl、为Ar。
(1)根据分析可知①为碳,⑧分Si,故答案为:碳;Si;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,在这些元素中,最活泼的金属为Na,离子结构示意图是: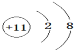 ;最活泼的非金属元素是F元素;Ar是最不活泼的元素,故答案为:
;最活泼的非金属元素是F元素;Ar是最不活泼的元素,故答案为: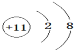 ;F;Ar;
;F;Ar;
(3)这些元素的最高价氧化物对应水化物中,HClO4的酸性最强;NaOH的碱性最强;氢氧化铝是能形两性氢氧化物,故答案为:HClO4;NaOH;Al;
(4)同周期自左而右原子半径减小,故原子半径Cl原子半径最小,故答案为:Cl;
(5)⑤和⑦两种元素最高价氧化物对应的水化物分别为NaOH、Al(OH)3,两者反应生成偏铝酸钠和水,离子方程式为:Al(OH)3 + OH- = AlO2- + 2H2O,故答案为:Al(OH)3 + OH- = AlO2- + 2H2O。


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】乙醇(C2H6O)的结构可能有两种:
(Ⅰ) (Ⅱ)
(Ⅱ)
关于确定其结构是(Ⅰ)而不是(Ⅱ)的方法,下列叙述中正确的是 ( )
A.1 mol乙醇与足量的钠作用生成0.5 mol H2B.乙醇具有挥发性
C.1 mol乙醇完全燃烧时生成3 mol水D.乙醇可以制酒精饮料
查看答案和解析>>
科目:高中化学 来源: 题型:
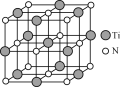
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
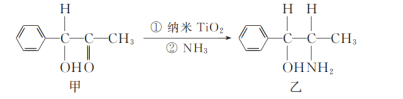
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用氢氧化钙和氯化铵固体制备NH3并探究其探究其性质。回答下列问题:
⑴制备NH3时发生反应的化学方程式为__;选取下图中装置制备并收集NH3,正确的连接顺序为_(填装置序号)。

⑵利用下图装置探究NH3的性质(实验开始前所有旋塞均关闭)

打开旋塞K1、K2,烧瓶中的实验现象为___;充分反应后,关闭旋塞K1,打开旋塞K3,烧瓶中的实验现象为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A可以作水果的催熟剂,D是食醋的主要成分。相关的转化关系如下:请回答下列问题:
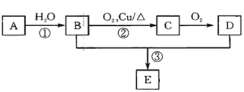
⑴A的结构简式为__________,反应①的反应类型是_______。
⑵B的同分异构体的结构简式为______;C的官能团名称是_______。
⑶反应③的化学方程式为_______________,该反应类型是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
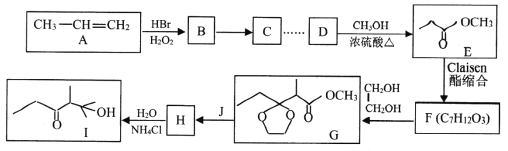
【题目】石油裂解可以得到乙烯、丙烯等小分子烃,它们是常见的有机化工原料。下图是以丙烯为原料合成有机物I的流程。
已知:
i.Claisen酯缩合: ![]()
ii. 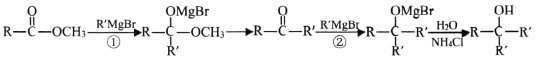 (②比①反应快)
(②比①反应快)
iii.![]() ,(R、R'代表烃基)
,(R、R'代表烃基)
回答下列问题:
(1)C的名称为_____________。Ⅰ中所含官能团的名称为______________________。
(2)B→C的反应类型是_______________。F的结构简式为_______________________。
(3)D→E的化学方程式为___________________________。
(4)由F到H过程中增加一步先生成G再生成H的目的是__________________________。
(5)化合物K与E互为同分异构体,已知1molK能与2mol金属钠反应,则K可能的链状稳定结构有_______种(两个一OH连在同一个碳上不稳定:一OH连在不饱和的双键碳、叁键碳不稳定),其中核磁共振氢谱有三组峰的结构简式为_______________。(任写一种)
(6)完成下列以苯乙烯为原料,制备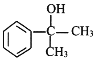 的合成路线(其他试剂任选) _____________。
的合成路线(其他试剂任选) _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是

A.反应的化学方程式:CO+2H2CH3OH
B.反应进行至3分钟时,正、逆反应速率相等,反应达到平衡状态
C.反应至10分钟,CO的转化率为75%
D.反应至3分钟,用甲醇来表示反应的平均速率为![]() mol/(L·min1)
mol/(L·min1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
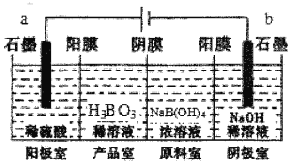
A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.反应一段时间以后,阴极室NaOH溶液浓度增大
C.当电路中通过3mol电子时,可得到1molH3BO3
D.B(OH)4-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抑制结核杆菌的药物 PAS-Na(对氨基水杨酸钠)的合成:
已知:①![]() (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)
②![]()
③R-Cl![]() R-OH
R-OH
下面是 PAS-Na 的一种合成路线(部分反应的条件未注明):

按要求回答问题:
(1)下列说法正确的是_______________;
A.化合物A只能发生氧化反应,不能发生还原反应
B.反应A →B为取代反应
C.反应II和反应III可以调换顺序
D.对氨基水杨酸 既能与酸反应,也能与碱反应
既能与酸反应,也能与碱反应
(2)写出反应Ⅰ的化学方程式_________________________;
(3)写出下列物质的结构简式:C:____________________;
(4)一种有机物 E,它是化合物 A 的同系物,每个分子中比 A 多二个碳原子;1H-NMR 谱显示 E 分子中含有苯环,且苯环上有两种不同化学环境的氢原子,请写出符合以上条件的 E 的所有同分异构体的结构简式: ____________________________。
(5)写出以 A 为原料制备 的合成路线(用流程图表示,无机试剂任选)_____________________。
的合成路线(用流程图表示,无机试剂任选)_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com