
【题目】PbI2是生产新型敏化太阳能电池的敏化剂﹣﹣甲胺铅碘的原料.合成PbI2的实验流程如图1: 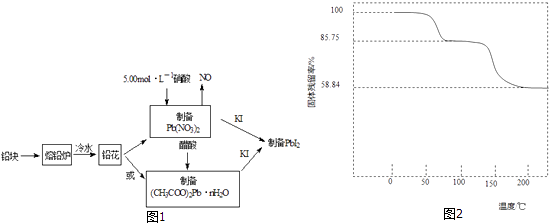
(1)将铅块制成铅花的目的是 .
(2)31.05g铅花用5.00molL﹣1的硝酸溶解,至少需消耗5.00molL﹣1硝酸mL,同时产生L(标准状况下)NO.
(3)取一定质量(CH3COO)2PbnH2O样品在N2气氛中加热,测得样品固体残留率( ![]() ×100%)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水).
×100%)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水).
①(CH3COO)2PbnH2O中结晶水数目n=(填数字).
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为(写结构简式).
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s)+Pb2+(aq)=R2Pb(s)+2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中.加入2~3滴酚酞溶液,用0.002500molL﹣1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL.计算室温时PbI2 的Ksp (请给出计算过程).
【答案】
(1)增大与酸的接触面,加快溶解反应速率
(2)80.00;2.24
(3)3;(CH3CO)2O
(4)解:n(H+)=n(NaOH)
=0.002500 molL﹣1×20.00mL×10﹣3LmL﹣1=5.000×10﹣5mol
n[Pb2+(aq)]= ![]() n(H+)=2.500×10﹣5mol
n(H+)=2.500×10﹣5mol
c(Pb2+)= ![]() =1.000×10﹣3 molL﹣1
=1.000×10﹣3 molL﹣1
Ksp(PbI2)=c(Pb2+)c2(I﹣)=4c3(Pb2+)=4×(1.000×10﹣3)3=4.000×10﹣9,
【解析】解:(1.)将铅块制成铅花,是为了增大与酸反应的接触面积,加快溶解反应速率,所以答案是:增大与酸的接触面,加快溶解反应速率;
(2.)31.05g铅的物质的量为 ![]() =0.15mol,根据反应方程式可知消耗的HNO3的物质的量为0.15mol×
=0.15mol,根据反应方程式可知消耗的HNO3的物质的量为0.15mol× ![]() =0.4mol,生成的NO的物质的量为0.15mol×
=0.4mol,生成的NO的物质的量为0.15mol× ![]() =0.1mol,则硝酸溶液的体积为0.4mol÷5.00molL﹣1=0.08L=80.0mL,生成NO的体积为0.1mol×22.4L/mol=2.24L,
=0.1mol,则硝酸溶液的体积为0.4mol÷5.00molL﹣1=0.08L=80.0mL,生成NO的体积为0.1mol×22.4L/mol=2.24L,
所以答案是:80.0;2.24;
(3.)①假设样品的起始质量为100克,根据固体残留率的公式可知,75℃时剩余固体为87.75克,生成的水质量为100g﹣87.75g=12.25g,则醋酸铅与水的物质的量之比为 ![]() :
: ![]() =1:3,则n=3,
=1:3,则n=3,
所以答案是:3;
②铅的氧化物质量为58.84克,醋酸铅的物质的量为= ![]() =
= ![]() mol,根据铅原子守恒,铅的氧化物(PbOx)的物质的量为
mol,根据铅原子守恒,铅的氧化物(PbOx)的物质的量为 ![]() mol,此氧化物的摩尔质量为
mol,此氧化物的摩尔质量为 ![]() =223g/mol,为PbO,有机物的质量为85.75g﹣58.84g=26.91g,此有机物分子内应含有四个碳原子,物质的量为
=223g/mol,为PbO,有机物的质量为85.75g﹣58.84g=26.91g,此有机物分子内应含有四个碳原子,物质的量为 ![]() mol,摩尔质量=
mol,摩尔质量= ![]() mol=102,根据原子守恒可知有机物的分子式为C4H6O3 , 结构简式为(CH3CO)2O,
mol=102,根据原子守恒可知有机物的分子式为C4H6O3 , 结构简式为(CH3CO)2O,
所以答案是:(CH3CO)2O;


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A. 标准状况下,22.4LH2O中含有NA个水分子
B. 1molCl2与足量的铁发生反应,转移的电子总数为3NA
C. 常温常压下,48gO3和O2混合气体含有的氧原子数为3NA
D. 同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应原理:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,并利用下列装置制取碳酸氢钠粗品,实验装置正确且能达到实验目的是( )
A.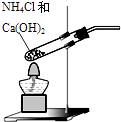
用装置制取氨气
B.
用装置制取二氧化碳
C.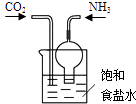
用装置制取碳酸氢钠
D.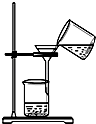
用装置分离碳酸氢钠与母液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质发生反应时,生成物不因反应条件(浓度、温度或催化剂等)的不同而不同的是
A. 铜与硝酸B. 乙醇与氧气
C. 钠与氧气D. 一氧化碳与氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序中错误的是
A.原子半径:O<S<NaB.稳定性:pH3>H2S>NH3
C.酸性:H3PO4<H2SO4<HClO4D.碱性:Al(OH)3<Mg(OH)2<NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 标准状况下,22.4LCCl4中含有的碳原子数为6.02×1023
B. 常温常压下,32gO3中含有的分子数为2×6.02×1023
C. 1mol·L-1Al2(SO4)3中含有的铝离子数为2×6.02×10 23
D. 2molCl2与足量NaOH完全反应,转移电子数为2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3molP和2.5molQ置于2L密闭容器中,发生如下反应:3P(g)+Q(g)x M(g)+2N(g),5min后达到平衡生成1molN,经测定M的平均速率是0.1mol/(Lmin),下列叙述不正确的是( )
A.P的平均反应速率为0.15 mol/(Lmin)
B.Q的平衡浓度为1 mol/L
C.Q的转化率为25%
D.x等于2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com