
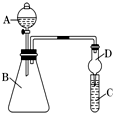
 某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:分析 Ⅰ.(1)根据金属活动性顺序表可以判断钠、钾、镁、铝的活泼性,活泼性越强,与盐酸反应越剧烈;根据电子守恒比较生成氢气体积大小;
(2)硫离子被氯气氧化成硫单质,据此写出反应的离子方程式.
Ⅱ.(1)氯气能够将碘离子氧化成碘单质;球形干燥管具有防止倒吸的作用;氯气有毒,氯气能够与氢氧化钠溶液反应;
(2)盐酸酸性强于碳酸,二氧化碳能使石灰水变浑浊;盐酸挥发,应排除实验中干扰.
解答 解:Ⅰ.(1)金属活泼性顺序为:钾>钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;生成1mol氢气需要得到2mol电子,1mol钾、钠都失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝,
故答案为:钾;铝;
(2)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:S2-+Cl2═S↓+2Cl-,
故答案为:S2-+Cl2═S↓+2Cl-;
Ⅱ.(1)浓盐酸和高锰酸钾反应生成氯气,氯气具有强氧化性,可与碘化钾反应生成碘,因淀粉遇碘变蓝色,则可观察到溶液变蓝,球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,氯气有毒,不能排放到空气中,可与氢氧化钠溶液反应而被吸收,则可用氢氧化钠溶液进行尾气吸收,少量时,也可用石灰水吸收,
故答案为:变蓝;防止溶液倒吸;NaOH;
(2)因碳酸比硅酸强,二氧化碳可与硅酸钠反应生成硅酸沉淀,溶液变浑浊,从B中挥发出的HCl也会和硅酸钠溶液反应生成硅酸,氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和D之间增加装有饱和NaHCO3溶液的洗气瓶,改进后C中发生反应的化学方程式是Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3(或Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3,
故答案为:有白色沉淀生成;从B中挥发出的HCl也会和硅酸钠溶液反应生成硅酸;D;Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3(或Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3.
点评 本题考查了探究金属单质的金属性强弱、非金属单质的非金属性强弱方法,题目难度中等,正确掌握判断金属性、非金属性强弱的方法,明确除杂试剂的作用原则:除去装置,不能引进新的杂质.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 萃取 | B. | 蒸发灼烧 | C. | 用Fe置换 | D. | 电解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯碱工业的阳极反应式:2Cl--2e-═Cl2↑ | |
| B. | 钢铁吸氧腐蚀的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 碱性环境下氢氧燃料电池正极反应式:O2+2H2O+4e-═4OH- | |
| D. | 酸性环境下氢氧燃料电池负极反应式:H2-2e-+2OH-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油与水不相溶,可以用裂化汽油萃取溴水中的溴 | |
| B. | 石油含有烷烃、环烷烃、芳香烃,煤含有苯、甲苯、二甲苯等有机物 | |
| C. | 煤的气化、液化是使煤变成清洁能源,减小环境污染的有效途径 | |
| D. | 沸点范围:汽油>煤油>柴油>重油 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
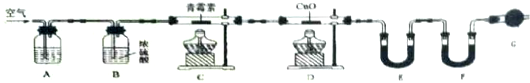
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 并不是所有物质都含有化学键 | B. | 只有非金属原子间才能形成共价键 | ||
| C. | 单质不可能含有离子键 | D. | 共价化合物中不可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N5+离子中含有36个电子 | B. | O2与O4属于同位素 | ||
| C. | C60比金刚石熔点高 | D. | H2与H3属于同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com