
| A. | 强酸和强碱的中和反应的活化能接近于零,所以反应速率很高 | |
| B. | 过程的自发性既能用于判断过程的方向,也能用于判断过程发生的速率 | |
| C. | 电解质溶液导电的过程中,一定发生了电解质溶液的电解 | |
| D. | 溶解度较小的BaSO4在一定条件下也可以转化为溶解度略大的BaCO3 |
分析 A、酸和碱反应不需要外界做功的条件下就能发生,说明它们已经处于活跃状态,因此活化能接近0;
B、过程的自发性与反应速率无关;
C、电解质溶液导电时,阴阳离子在两极上得失电子;
D、当溶液中BaCO3的浓度商大于溶度积时,会生成BaCO3沉淀.
解答 解:A、酸和碱反应不需要外界做功的条件下就能发生,说明它们已经处于活跃状态,因此活化能接近0,所以反应速率很高,故A正确;
B、过程的自发性与反应速率无关,只能确定过程能否发生,故B错误;
C、电解质溶液导电时,阴阳离子在两极上得失电子,所以电解质溶液导电的过程中,一定发生了电解质溶液的电解,故C正确;
D、在硫酸钡悬浊液中加入饱和的碳酸钠溶液,由于碳酸根离子浓度大,则溶液中BaCO3的浓度商会大于BaCO3的溶度积,因此会生成BaCO3沉淀,所以溶解度较小的BaSO4在一定条件下也可以转化为溶解度略大的BaCO3,故D正确.
故选B.
点评 本题考查了反应焓变的分析应、溶度积常数的应用等,注意对活化能和化学反应实质的理解应用,掌握基础是解题关键,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-4mol/L | |
| B. | pH=x的CH3COOH溶液100mL,稀释10倍后pH=y,x-y>1 | |
| C. | pH=2的NaHC2O4溶液与pH=12的NaOH溶液以任意比混合,混合液中:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | pH相同的①CH3COONa、②Na2CO3 、③NaClO三种溶液中c(Na+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
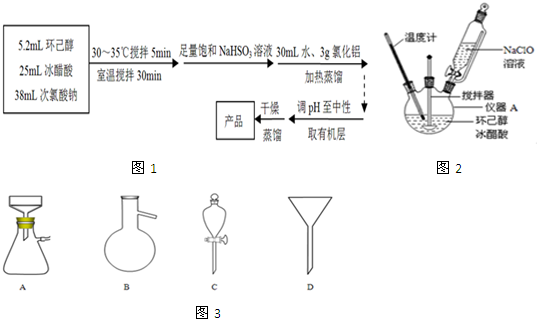

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOCCOOH | D. | (CH3)3CCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾与漂白粉常用于自来水的净化与消毒,这两者的作用原理是一样的 | |
| B. | 为了防止中秋月饼的富脂食物因被氧化而变质,常在包装袋里放生石灰 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀,该方法叫牺牲阳极的阴极保护法 | |
| D. | 酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
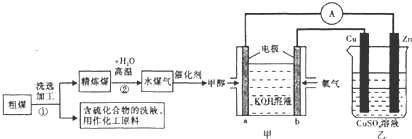
| 实验组 | 温度/C | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入HCOOH溶液后溶液显碱性:c(HCOO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1HF溶液与0.1mol•L-1KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含共价键 | B. | 共价化合物中可能含离子键 | ||
| C. | 离子化合物中不含共价键 | D. | 共价化合物中不含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com