


科目:高中化学 来源: 题型:
| A、将SO2通入溴水溶液中溴水褪色,可以说明SO2有漂白性 |
| B、将淀粉和稀硫酸混合后加热,再加入银氨溶液加热,可以检验淀粉水解后的产物 |
| C、将C2H5OH与浓硫酸170℃共热,制得的气体直接通入酸性KMnO4溶液,可以检验生成的乙烯气体 |
| D、向AgCl浊液中滴加KI溶液,白色沉淀转化为黄色沉淀,可以说明AgI比AgCl更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 【物质结构与性质】
【物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
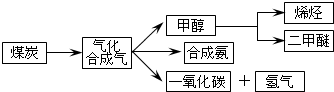
| c(H2)?c(CO) |
| c(H2O) |
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol/L) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.查看答案和解析>>
科目:高中化学 来源: 题型:
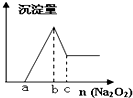 有一透明溶液,可能含有下列离子中的一种或几种,Al3+、Cu2+、Na+、H+、
有一透明溶液,可能含有下列离子中的一种或几种,Al3+、Cu2+、Na+、H+、查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解NaOH溶液时,溶液浓度将减小,pH增大 |
| B、电解H2SO4溶液时,溶液浓度将增大,pH减小 |
| C、电解Na2SO4溶液时,溶液浓度将增大,pH变大 |
| D、电解NaCl溶液时,溶液浓度将减小,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- |
| B、含有0.1mol?L-1 Fe3+的溶液中:K+、Mg2+、I-、SO42- |
| C、能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- |
| D、c(Al3+)=0.5mol?L-1的溶液中:Na+、K+、[Al(OH)4]-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com