
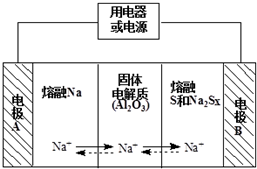
 钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )| A. | 放电时,内电路中的Na+的从B向A移动 | |
| B. | 充电时,电极A接电源的正极 | |
| C. | 充电时,总反应为2Na+xS=Na2Sx | |
| D. | 放电时,正极的电极反应式为xS+2e-=Sx2- |
分析 根据图片知,放电时,Na失电子发生氧化反应,所以A作负极、B作正极,负极反应式为2Na-2e-═2Na+、正极反应式为xS+2e-═Sx2-,充电时A为阳极、B为阴极,阴极、阳极电极反应式与负极、正极反应式正好相反,放电时,电解质中阳离子向正极移动、阴离子向负极移动.
解答 解:根据图片知,放电时,Na失电子发生氧化反应,所以A作负极、B作正极,负极反应式为2Na-2e-═2Na+、正极反应式为xS+2e-═Sx2-,充电时A为阳极、B为阴极,阴极、阳极电极反应式与负极、正极反应式正好相反,放电时,电解质中阳离子向正极移动、阴离子向负极移动,
A、放电时,Na失电子发生氧化反应,所以A作负极、B作正极,电解质中阳离子钠离子向正极B移动,故A错误;
B、充电时A是阴极,应该连接电源负极,电极B接电源的正极,故B错误;
C、放电时,负极反应式为2Na-2e-═2Na+、正极反应式为xS+2e-═Sx2-,总反应:2Na+xS═Na2Sx,充电时,总反应为,Na2Sx=2Na+xS,故C错误;
D、放电时,负极反应式为2Na-2e-═2Na+,正极反应式为xS+2e-═Sx2-,故D正确;
故选D.
点评 本题考查化学电源新型电池,正确获取图片提供信息是解本题关键,根据得失电子确定正负极、阴阳极,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 25℃时,50 g 98%浓硫酸和50 g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 标准状况下,活泼金属与稀硫酸反应转移2NA个电子时,可产生22.4 L 气体 | |
| C. | 6.4g SO2溶于水配成1L溶液,含有H2SO3的分子数为0.1NA | |
| D. | 1 mol N2与足量H2反应生成NH3,有6NA个共价键生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
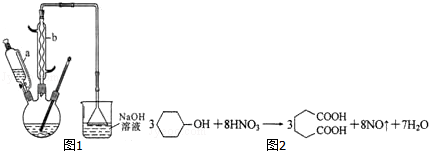
| 物质 | 密度 | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
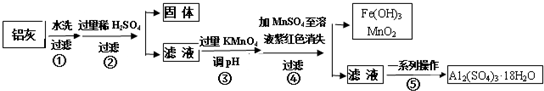
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| Z | W | Q |
| A. | Z位于第3周期 IIIA族 | |
| B. | X、Z、W、Q等元素的最高正价等于其所在族的族序数 | |
| C. | Y元素气态氢化物比W元素的气态氢化物更稳定,是因为前者分子间形成了氢键 | |
| D. | X的最高价氧化物对应的水化物和X的氢化物形成的化合物含有离子键、共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com