
| A. | Ba2+、Cl-、NO3-、K+ | B. | HCO3-、K+、SO42-、Cl- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | Na+、Cl-、K+、SO42-、 |
分析 将铝条投到某溶液中产生氢气,该溶液中存在大量氢离子或氢氧根离子,
A.酸性条件下硝酸根离子具有强氧化性,与铝反应不会生成氢气;
B.碳酸氢根离子与氢离子、氢氧根离子反应;
C.酸性条件下硝酸根离子能够氧化亚铁离子,亚铁离子与氢氧根离子反应;
D.四种离子之间不反应,都不与氢离子、氢氧根离子反应.
解答 解:将铝条投到某溶液中产生氢气,该溶液呈酸性或强碱性,溶液中存在大量氢离子或氢氧根离子,
A.NO3-在酸性条件下与铝反应不会生成氢气,在酸性溶液中不能大量共存,故A错误;
B.HCO3-与氢离子、氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.Fe2+、NO3-在酸性条件下发生氧化还原反应,Fe2+与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.Na+、Cl-、K+、SO42-之间不反应,都不与氢离子、氢氧根离子反应,在溶液中一定能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
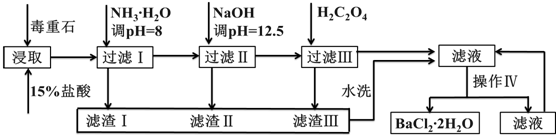
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 2:5 | C. | 3:4 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
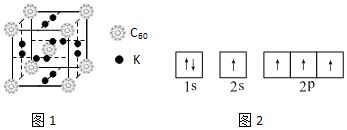
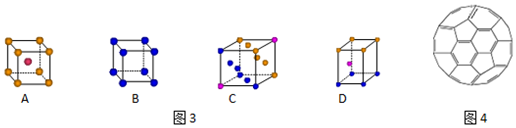
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、NO3-、HCO3- | B. | Na+、Fe3+、Cl-、SCN- | ||
| C. | Na+、Al3+、NO3-、Cl- | D. | K+、Cu2+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 硝酸铵溶于水温度降低,这个过程吸热热量 | |
| C. | 同温同压下,H2和Cl2在光照和点燃条件下的△H不同 | |
| D. | 自发反应的熵一定增大,非自发反应的熵一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
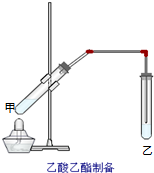 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com