
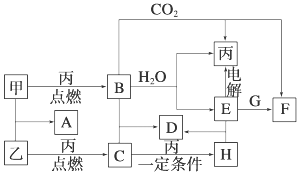
 .
.分析 甲、乙、丙为常见单质,A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,均含有Na元素,B能与二氧化碳、水反应生成单质丙,则B为Na2O2,丙为O2,甲为Na,E为NaOH,F为Na2CO3,G的焰色反应为黄色,与氢氧化钠反应得到碳酸钠,判断G为NaHCO3;C能使品红溶液褪色,由单质乙与氧气反应得到,则乙为S,A为Na2S,C为SO2,H为SO3,D为Na2SO4,据此解答.
解答 解:(1)由上述分析可知,丙为O2,H为SO3,故答案为:O2;SO3;
(2)由上述分析可知,A为Na2S,电子式为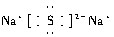 ,故答案为:
,故答案为: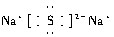 ;
;
(3)B+C→D是过氧化钠与二氧化硫反应生成硫酸钠,反应化学方程式为:Na2O2+SO2=Na2SO4;
E+G→F是氢氧化钠和碳酸氢钠溶液的反应生成碳酸钠,反应的离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:Na2O2+SO2=Na2SO4;HCO3-+OH-=CO32-+H2O.
点评 本题考查无机物推断,颜色反应性质、转化关系中特殊转化等是推断突破口,需要学生熟练掌握元素化合物知识,难度中等.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:选择题

| A. | A、D所含元素的原子序数大小:A一定比D小 | |
| B. | A、F所含元素的原子半径大小:A一定比F大 | |
| C. | B、E含有化学键类型相同 | |
| D. | 若常温下D为固体,则B可以与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO2)=0.25 mol•L-1 | B. | c(O2)=0.12 mol•L-1 | ||
| C. | c(SO2)+c(SO3)=0.15 mol•L-1 | D. | c(SO3)+c(O2)=0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5个 | B. | 3个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明氧化性:H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| B | 鉴别KBr溶液和KI溶液 | 分别加入新制氯水,再加入CCl4振荡、静置,观察 |
| C | 配制100mL 1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| D | 除去CuO中混有的Al2O3 | 加入过量盐酸溶液后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 88g乙酸乙酯中存在的共价键总数为NA | |
| C. | 加热时,含2molH2SO4的浓硫酸与足量铜反应,转移的电子数为2NA | |
| D. | 1mol羟基所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
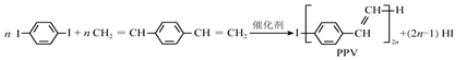
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. | H2C═CH CH═CH2和苯乙烯互为同系物 CH═CH2和苯乙烯互为同系物 | |
| D. | 通过质谱法测定PPV的平均相对分子质量,可得其聚合度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加H2的量 | |
| B. | 将容器体积缩小一半 | |
| C. | 保持容器内体积不变,充入Ar使体系压强增大 | |
| D. | 充入Ar,保持容器内压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一块质量为5.0g的铝片投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图所示的曲线来表示,回答下列问题:
将一块质量为5.0g的铝片投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图所示的曲线来表示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com