
【题目】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。
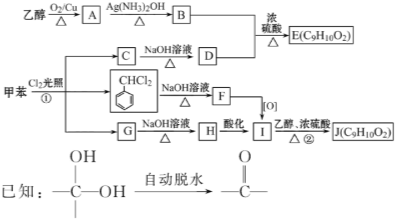
请回答:
(1)写出下列反应方程式
①B+D→E_____________________________。
②G→H_______________________________。
(2)①的反应类型为__________;②的反应类型为________;F的结构简式为__________。
(3)E、J有多种同分异构体,写出符合下列条件的4种同分异构体的结构简式。要求:①与E、J属同类物质②苯环上有两个取代基且苯环上的一氯代物只有两种。___________________
【答案】(1)  ;
;
② ;
;
(2)取代反应,酯化反应(或取代反应) , 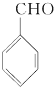 ;
;
(3)
![]()
![]()
【解析】
试题分析:(1)乙醇和氧气在铜作催化剂饿条件下,被氧化成乙醛,乙醛被银氨溶液氧化成乙酸,即B为CH3CHOOH,氯气在光照条件下取代甲苯甲基上的氢原子,C为1个氯原子取代甲基上的氢原子,其结构简式为:![]() ,C在氢氧化钠的水溶液中发生水解反应,羟基取代氯原子,其D的结构简式为:
,C在氢氧化钠的水溶液中发生水解反应,羟基取代氯原子,其D的结构简式为:![]() ,①发生酯化反应,其反应方程式为:
,①发生酯化反应,其反应方程式为: ;②G为三个氯原子取代甲基上的三个氢原子,G在氢氧化钠溶液发生水解,根据信息,H应为苯甲酸钠,反应方程式为:
;②G为三个氯原子取代甲基上的三个氢原子,G在氢氧化钠溶液发生水解,根据信息,H应为苯甲酸钠,反应方程式为: ;
;
(2)①根据上述分析,其反应为取代反应,H酸化,生成I,则I为苯甲酸,苯甲酸和乙醇发生酯化反应;
(3)①此有机物属于酯类,苯环上有两个取代基,苯环上的一氯代物有两种,说明是对称结构,其结构简式为:![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】铝土矿是工业上制取铝的基本原料。为了除去铝土矿中的少量Fe2O3和SiO2等杂质制得纯净的Al2O3,某化学兴趣小组设计探究实验,操作过程如图所示:(A试剂有挥发性):
(1)操作过程中的试剂:A是______________盐酸、过滤
,B是______________;氢氧化钠、过滤
;;
(2)溶液甲到溶液乙的离子方程式为______________;
(3)在溶液乙中通入过量C02后发生反应的离子方程式为______________;
(4)如果A、B试剂互换,则C02应换为____________试剂,将溶液乙蒸干并灼烧,所得固体产物的主要成分是______________Al2O3、NaCl
(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】作为新世纪的年轻公民都应具有一定的化学科学素养,否则,在工作和生活中就可能闹笑话。下列有关媒体的报道与化学知识不相违背的是( )
A. 这种人工皂不含任何化学物质
B. 该科研人员发明了一种特殊催化剂,可以使水变为汽油
C. 有关部门利用明矾对饮用水进行消毒杀菌,从而解决了灾民饮水难的问题
D. 该科研机构发明了一种用植物秸秆生产乙醇的新工艺
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000molL﹣1盐酸滴入20.00mL 1.000molL﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是:
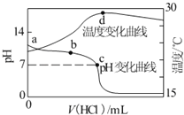
A.a点由水电离出的c(H+)=1.0×10﹣14molL﹣1
B.b点:c(NH4+)+c(NH3H2O)=c(Cl﹣)
C.c点:c(Cl﹣)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年中国十大科技成果之一是:我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃和氢气等化学品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):
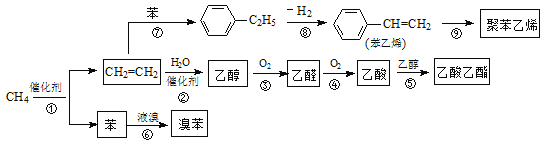
(1)乙烯分子中所含官能团名称为 ;乙酸分子中所含官能团名称为 。
(2)聚苯乙烯的结构简式为 。
(3)图中9步反应中只有两步属于取代反应,它们是 (填序号)。
(4)写出下列反应的化学方程式(注明反应条件):反应③为 ;反应⑤为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含原子数一定相等的是( )
A. 同质量、不同密度的N2和CO2 B. 同温度、同体积的H2和N2
C. 同体积、同密度的C2H4和C3H6 D. 同压强、同体积的N2O和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
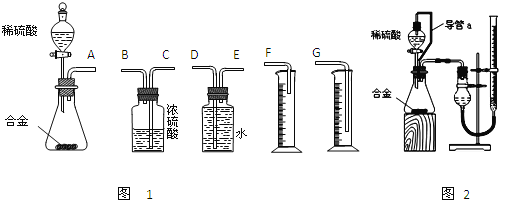
【题目】镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
【方案一】(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0mol/L NaOH溶液中,使其反应完全,过滤、洗涤、干燥、称量固体。实验中发生反应的化学方程式是__________.该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”、“偏低”或“无影响”)。
【方案二】
将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积.
(1)同学们拟选用下列实验装置完成实验如图1:
①你认为最简易的装置其连接顺序是:A接______接______接______(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因______.
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是______。
A、待实验装置冷却后再读数
B、上下移动量筒F,使其中液面与广口瓶中液面相平
C、上下移动量筒G,使其中液面与广口瓶中液面相平
D、视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了图2所示的实验装置。
①装置中导管a的作用是______。
②怎样检查图2装置的气密性____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量二价铁和三价铁的氧化物及硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
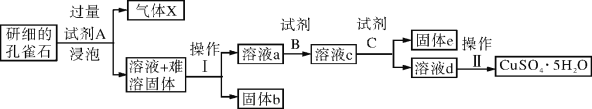
(1)试剂A的化学式是_____________;操作Ⅰ的名称是______________;
(2)生成气体X的化学方程式为:_________________________________。
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用_________
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)已知:

①试剂C的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离。试剂C宜选用__________:
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
②为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为__________。
(5)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论) ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com