
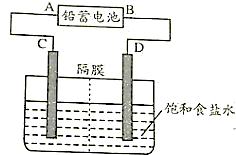
分析 (1)电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色说明C电极为阳极,电源A为正极;
(2)①依据电解氯化钠生成氯气电极反应计算转移电子物质的量;
②依据铅蓄电池和电解池中电子转移守恒计算生成氢气的物质的量及体积;根据反应2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑计算出反应后氢氧化钠溶液的浓度及溶液的pH.
解答 解:(1)电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色说明C电极为阳极,D为阴极,电源A为正极,
故答案为:正极;
(2)①电解饱和食盐水生成氯气的电极反应为:2Cl--2e-=Cl2↑,收集到11.2L(标准状况下)氯气物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,转移电子物质的量为:0.5mol×2=1mol,
故答案为:1;
②蓄电池消耗H2SO4 0.02mol,依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗0.02mol硫酸电子转移0.02mol,电解食盐水阴极电极反应为2H++2e-=H2↑,则转移0.02mol电子生成氢气的物质的量为0.01mol,标准状况体积为:22.4L/mol×0.01mol=0.224;
根据反应2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑可知生成0.01mol氢气时会同时生成0.02molNaOH,氢氧根离子的浓度为:$\frac{0.02mol}{2L}$=0.01mol/L,则所得溶液的pH=12,
故答案为:0.224L;12.
点评 本题考查了原电池、电解池工作原理,题目难度中等,注意掌握电解池和原电池工作原理,明确电极反应的书写方法及电子守恒在化学计算中的应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
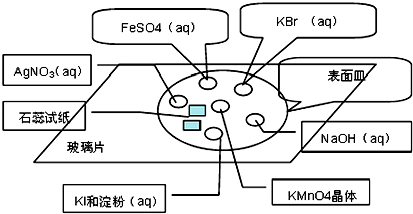
| A. | 加入硝酸银溶液时有白色沉淀产生 | |
| B. | 加入盐酸时有无色无味气体产生,该气体能使澄清石灰水变浑浊 | |
| C. | 加入氯化钙溶液时有白色沉淀产生,再加稀盐酸沉淀溶解,且产生可使澄清石灰水变浑浊的无色无味气体 | |
| D. | 加入氢氧化钡溶液时有白色沉淀,再加稀盐酸反应现象如C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1,3-环己二烯)的各步反应方程式
(1,3-环己二烯)的各步反应方程式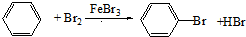
 +3H2$\stackrel{一定条件下}{→}$
+3H2$\stackrel{一定条件下}{→}$
 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +H2O+NaBr
+H2O+NaBr +Br2→
+Br2→
 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:填空题
现有以下物质:①NaHCO3晶体②液态SO3③HF④盐酸⑤蔗糖⑥铜⑦KOH固体⑧氨水。请回答下列问题;
(1)属于非电解质的是________________,
(2)属于电解质的_______________,
(3)属于电解质的依次写出其在水中的电离方程式:______________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mo1)随时间t的变化如图2-10-2所示。已知达平衡后,降低温度,A的转化率将 增大。
增大。

(1)根据图 2-10-2数据,写出该反应的化学方程式________________;此反应的平衡常数表达式K=______________。从反应开始到达第一次平衡时的平均反应速率v(A)为_________。
2-10-2数据,写出该反应的化学方程式________________;此反应的平衡常数表达式K=______________。从反应开始到达第一次平衡时的平均反应速率v(A)为_________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是________________。
(3)图2-10-3表示此反应的反应速率v和时间t的关系。各阶段的平衡常数如下表所示:
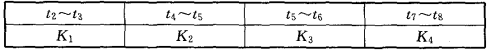
根据图2-10-3判断,在t3和t6时刻改变的外界条件分别是__________和____________;K1、K2、K3、K4之间的关系为__________(用“>”“<”或“=”连接)。平衡时A的转化率最大的一段时间是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com