
| A. | CH4 分子的比例模型: | B. | NH4Cl的电子式: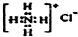 | ||
| C. | 硫离子的离子结构示意图: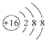 | D. | 乙烯的结构简式CH2 CH2 |
分析 A. 为球棍模型,比例模型主要体现出各原子的相对体积大小;
为球棍模型,比例模型主要体现出各原子的相对体积大小;
B.氯离子为阴离子,需要标出最外层电子;
C.硫离子的核电荷数为16,最外层满足8电子稳定结构;
D.乙烯的结构简式中没有标出碳碳双键结构.
解答 解:A.CH4分子为正四面体结构,碳原子相对体积大于氢原子,其比例模型为: ,故A错误;
,故A错误;
B.氯化铵是离子化合物,由氨根离子与氯离子构成,氯离子需要标出最外层电子,氯化铵正确的电子式为 ,故B错误;
,故B错误;
C.硫离子的核外电子总数为18,最外层达到8电子稳定结构,硫离子的离子结构示意图为: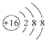 ,故C正确;
,故C正确;
D.乙烯分子中含有1个碳碳双键,其正确的结构简式为:CH2=CH2,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、离子结构示意图、比例模型、结构简式等知识,明确常见化学用语的书写原则为解答关键,试题侧重考查学生的规范答题能力.


科目:高中化学 来源: 题型:推断题
 ,A与B可形成另一种气态化合物Z,写出实验室制取Z的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
,A与B可形成另一种气态化合物Z,写出实验室制取Z的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 |
| 金刚石:3110℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1410℃ | Na:98℃ | HCl:-114℃ | KCl:776℃ |
| 硼晶体:2300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{13}$C原子内的中子数为6 | B. | ${\;}_{6}^{13}$C核外电子数为6 | ||
| C. | ${\;}_{6}^{13}$C质量数为13 | D. | ${\;}_{6}^{13}$C与$\frac{12}{6}$C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,该主要成分完全燃烧的化学方程式CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
,该主要成分完全燃烧的化学方程式CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 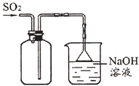 收集SO2 收集SO2 | |
| B. | 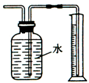 测量Cu与浓硝酸反应产生气体的体积反应 测量Cu与浓硝酸反应产生气体的体积反应 | |
| C. | 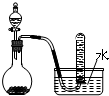 二氧化锰固体和双氧水制取O2 二氧化锰固体和双氧水制取O2 | |
| D. |  吸收HCl 吸收HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com