
【题目】实验室可用如下方法由NaOH溶液制取Na2CO3·10H2O:
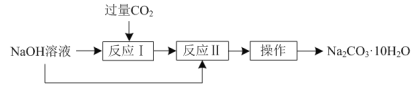
(1)“反应Ⅰ”的化学方程式为___。
(2)“反应Ⅱ”的离子方程式为___。
(3)“操作”的名称为___。
【答案】NaOH+CO2=NaHCO3 HCO![]() +OH-=CO
+OH-=CO![]() +H2O 蒸发浓缩、冷却结晶、过滤
+H2O 蒸发浓缩、冷却结晶、过滤
【解析】
NaOH溶液可以与过量的CO2反应生成NaHCO3,碳酸氢钠又可以与NaOH溶液反应生成碳酸钠,最后通过结晶的方法即可从碳酸钠溶液中获得Na2CO3·10H2O,再将其过滤出即可。
(1)NaOH溶液中通入过量的CO2反应生成NaHCO3,相关的化学方程式为:NaOH+CO2=NaHCO3;
(2)反应Ⅱ是NaHCO3与NaOH溶液的反应,相关的离子方程式为:HCO![]() +OH-=CO
+OH-=CO![]() +H2O;
+H2O;
(3)由碳酸钠溶液获取碳酸钠晶体,可通过蒸发浓缩、冷却结晶、过滤即可获得Na2CO3·10H2O。


科目:高中化学 来源: 题型:
【题目】固体NH4NO3受热分解的产物较复杂,分解时发生的反应遵循守恒,从得失电子守恒和元素守恒方面分析,对NH4NO3热分解的产物猜想不正确的是( )
A.N2、HNO3、H2OB.N2O、H2O
C.NO2、N2O、H2OD.NH3、HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将VmLNO和NO2的混合气体通过水吸收后,得到amL无色气体A。将此无色气体A与等体积的O2混合,再通过水充分吸收后,收集到4mL无色气体B。试回答:
(1)气体A是___;气体B是___。
(2)A气体的体积是___毫升。
(3)V的取值范围是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O
B.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C.氯化铝溶液与氨水反应:Al3++4OH-=AlO![]() +2H2O
+2H2O
D.碳酸钠溶液与稀盐酸的反应:Na2CO3+2H+=CO2↑+H2O+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
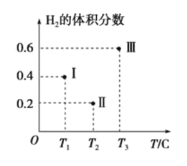
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙可由如图反应得到,则丙的结构不可能是

A. CH3CBr2CH2CH3B. (CH3)CBrCH2Br
C. CH3CH2CHBrCH2BrD. CH3(CHBr)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的全部转变成所需产物,不产生副产物,实现零排放。以下反应中符合绿色化学原理的是
A. 乙烯与O2在银催化下生成环氧乙烷![]()
B. 乙烷与氯气制备氯乙烷
C. 苯和乙醇为原料,在一定条件下生产乙苯
D. 乙醇和浓硫酸共热制备乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组以海带为原料获得少量碘水,并以四氯化碳(沸点76.80C)为溶剂将碘从碘水中提取出来,具体过程如图所示。
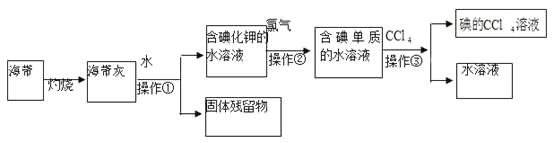
请回答下列问题:
(1)操作①的名称为________________、_________________;
(2)向含碘单质的水溶液中加入CCl4振荡、静置后,观察到的现象是______________________;
(3)操作③中,将含碘单质的水溶液与CCl4在分液漏斗中混合、振荡摇匀放在铁架台的铁圈上,分液漏斗的下端尖嘴处紧贴在承接的烧杯内壁上静置后,下面的操作步骤是_______________________。
(4)从含碘的有机溶剂中经过蒸馏可以提取碘和回收有机溶剂,该实验需要的主要玻璃仪器除酒精灯、烧杯、温度计、锥形瓶、牛角管外,还需要____________________,实验中温度计水银球所处位置为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上用铝土矿(主要成分为Al2O3、Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作流程如下:

请回答下列问题:
(1)操作①的名称:____________;
(2)沉淀②的化学式:____________;
(3)写出沉淀①与NaOH溶液反应的化学方程式:__________;
(4)写出滤液②里通入过量CO2后生成沉淀的离子方程式: ______,能否将滤液②中通入过量CO2换成加入过量盐酸? ____ (填能或不能),其理由是_______(用化学方程式表示)。
Ⅱ.无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿为原料制备无水AlCl3的工艺流程如下:

(1)铝在空气中有较强的抗腐蚀性,原因是___________________________。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式为___________________________。
(3)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16g无水AlCl3样品溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32g。
①写出上述除杂过程中涉及的离子方程式______________、_______________。
②产品中AlCl3的质量分数为___________。(保留两位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com