
实验室制Cl2的反应为4HCl(浓)+MnO2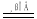 MnCl2+C12↑+2H2O.下列说法错误的是
MnCl2+C12↑+2H2O.下列说法错误的是
A.还原剂是HCl,氧化剂是MnO2
B.每生成1 molCl2,转移电子的物质的量为2 mol
C.每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
科目:高中化学 来源:2014-2015学年重庆市七校高三上学期期末联考理综化学试卷 (解析版) 题型:选择题
化学与人类生活、社会可持续发展密切相关。下列说法正确的是
A.大量吃加碘食盐可以防止131I的辐射
B.“天宫一号”使用的碳纤维,是一种新型有机高分子材料
C.用CO2合成聚碳酸酯可降解塑料,实现"碳"的循环利用
D.为改善食品的色、香、味并防止变质,可加入大量食品添加剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:填空题
(11分)(1)据报道以硼氢化合物NaBH4(H的化合价为-1价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。

写出该电池放电时负极的电极反应式: 。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l) + O2(g) = N2(g)+ 2H2O(l) △H = – 534 kJ·mol—1
H2O2(l)= H2O(l) + 1/2O2(g) △H = – 98.6 kJ·mol—1
写出常温下,N2H4(l) 与 H2O2(l)反应生成N2和H2O的热化学方程式 。
(3)O3可由臭氧发生器(原理如图所示)电解稀硫酸制得。

①图中阴极为 (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为:
(4)向一密闭容器中充入一定量一氧化碳跟水蒸气发生反应CO(g)+H2O(g) CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是____ _____(选填编号)。
CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是____ _____(选填编号)。
A.v正(H2O) = v逆(H2)
B.容器中气体的压强不再发生改变
C.H2O的体积分数不再改变
D.容器中CO2和H2的物质的量之比不再发生改变
E.容器中气体的密度不再发生改变
(5)温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol 的H2,反应中c(H2O)的变化情况如图所示

T1时反应CO(g)+H2O(g) CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化趋势的曲线。
CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化趋势的曲线。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.126C 、136C、146C 为碳元素的三种核素。元素周期表中碳的相对原子质量为12.01,说明自然界中的碳主要以126C的核素形式存在。146C为放射性核素,可用于同位素示踪
B.汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率
C.道尔顿、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识
D.地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油的成分与从石油中提取的柴油成分不同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为
A.0.2mol B.0.6mol
C.0.8mol D.1.0mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列各组离子在对应溶液中可能大量存在的是
A.水电离出的c(H+)=10-12mol·L-1的溶液:K+、Cu2+、SO32-、MnO4-
B.与铝粉反应能放出氢气的溶液:Na+、SO42-、HCO3-、Cl-
C.含有大量ClO-的溶液:H+、I-、SO42-、Cl-
D.pH=12的溶液:K+、Cl-、SO32-、SiO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:填空题
【化学——选修2化学与技术】(15分)
(一)(6分)下列叙述正确的是( )
A.合成氨的“造气”阶段会产生废气
B.电镀的酸性废液用碱中和后就可以排放
C.电解制铝的过程中,作为阳极材料的无烟煤不会消耗
D.使用煤炭转化的管道煤气比直接燃煤可减少环境污染
(二)工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:

(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式: 。
(2)用碱液浸出产品比用热水更好,理由是 。
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。

为使除汞达到最佳效果,应控制条件是 。
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)= mol·L-1。
[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在 ;该电极pH将 (填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:选择题
25℃,向50 mL 0.018 mol/L AgNO3 溶液中加入50 mL 0.02 mol/L 盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的体系中c(Ag+)为
A.1.8×10-7mol/L B.1.8×10-8 mol/L C.1.8×10-9mol/L D.1.8×10-10mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省等五校高三联考理综化学试卷(解析版) 题型:选择题
下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被 Fe2+还原为NO2 |
B | 向溶液中先滴加稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 | 溶液中一定含有SO42- |
C | 在0.1mol·L-1CH3COONa溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
D | 向淀粉溶液中加入稀H2SO4,水浴加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉没有水解生成葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com