
| 实验序号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
分析 (1)根据反应可知,生成气体的物质的量与消耗硝酸根离子的物质的量相等,据此计算出反应后a溶液中硝酸根离子浓度;
(2)根据a中数据判断b中混合物恰好完全反应,然后设出混合物中Cu2S、CuS的物质的量,分别根据总质量、生成气体的物质的量列式计算出Cu2S、CuS的物质的量;再根据反应方程式计算出反应中消耗氢离子的物质的量,然后根据c=$\frac{n}{V}$计算出消耗氢离子浓度,最后计算出剩余氢离子浓度及溶液的pH;
(3)根据(3)计算出64.0g混合物中含有的CuS、Cu2S的物质的量,然后利用极值法分别计算出生成NO的物质的量及体积,从而得出V的范围.
解答 解:(1)根据反应①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O、②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O可知,反应生成NO气体的物质的量与消耗硝酸根离子的物质的量相等,a实验中生成NO的物质的量为:$\frac{5.04L}{22.4L/mol}$=0.225mol,消耗硝酸的浓度为:$\frac{0.225mol}{0.1L}$=2.25mol/L,则反应后溶液浓度为5mol/L-2.25mol/L=2.75mol/L,
故答案为:2.75mol/L;
(2)9.6g混合物生成5.04LNO气体,12.8g混合物能够生成一氧化氮的体积为:$\frac{12.8g}{9.6g}$×5.04L=6.72L,说明b中混合物完全反应,
设12.8g的样品中CuS的物质的量为x,Cu2S的物质的量为y,
根据质量可得:①96x+160y=12.8,
根据生成气体可得:②$\frac{8}{3}$x+$\frac{10}{2}$y=$\frac{6.72L}{22.4L/mol}$=0.3,
根据①②解得:x=y=0.05mol,
根据方程式①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O、②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O可知消耗氢离子的物质的量为:n(H+)=0.05mol×$\frac{8}{3}$+0.05mol×$\frac{16}{3}$=0.4mol,
故消耗氢离子的浓度为:c(H+)=$\frac{0.4mol}{0.1L}$=4mol/L,
所以剩余氢离子浓度为:c(H+)=5mol/L-4mol/L=1mol/L,反应后b溶液的pH=0,
故答案为:0;
(3)100mL 5mol/L的稀硝酸中含有硝酸的物质的量为:5mol/L×0.1L=0.5mol,
根据(2)可知,64g样品中CuS、Cu2S的物质的量为:n(Cu2S)=n(CuS)=0.05mol×$\frac{64g}{12.8g}$=0.25mol,
若HNO3只与CuS反应:3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O,0.25molCuS完全反应消耗硝酸:0.25mol×$\frac{8}{3}$>0.5mol,硝酸不足,则根据反应可知生成NO的物质的量为:0.5mol,标况下NO体积为:V(NO)=0.5mol×22.4L/mol=11.2L;
若HNO3只与Cu2S反应:3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O,0.25molCu2S消耗硝酸:0.25mol×$\frac{16}{3}$>0.5mol,硝酸不足,根据反应可知生成NO的物质的量为:0.5mol×$\frac{10}{16}$=$\frac{5}{16}$mol,标况下NO体积为:22.4L/mol×$\frac{5}{16}$mol=7L,
所以c组产生气体体积(V)为:7L<V<11.2L,
故答案为:7L<V<11.2L.
点评 本题考查了混合物反应的计算,题目都能较大,正确判断b中混合物是否完全反应为解答关键,注意掌握质量守恒定律在化学计算中的应用,试题计算量较大,试题培养了学生的分析能力及化学计算能力.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:推断题
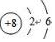 .A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)
.A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示) _.
_.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
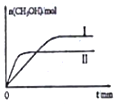 当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.
当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.| 物质 | H2(g) | C(s) | CO(g) |
| 燃烧热KJ/mol | 285.8 | 393.5 | 283.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
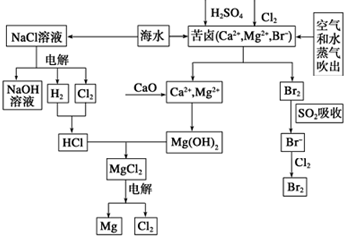 海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料.下图是海水综合利用的部分流程图,据图回答问题:
海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料.下图是海水综合利用的部分流程图,据图回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
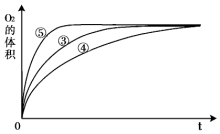 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-QkJ•mol-1 | |
| B. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-10QkJ•mol-1 | |
| C. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=+10QkJ•mol-1 | |
| D. | C4H10(g)+O2(g)═4CO2(g)+5H2O(g)△H=-10QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净的苯酚是粉红色的晶体,65℃以上时能与水互溶 | |
| B. | 苯酚是生产电木的单体之一,与甲醛发生缩聚反应 | |
| C. | 苯酚比苯更易发生苯环上的取代反应 | |
| D. | 苯酚有毒,也能配制洗涤剂和软药膏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com