
【题目】下列说法错误的是( )
A.C2H6和C4H10一定是同系物
B.C2H4和C4H8一定都能使溴水褪色
C.C3H6不只表示一种物质
D.单烯烃各同系物中碳的质量分数相同
【答案】B
【解析】解:A、C2H6和C4H10都属于烷烃,相差2个CH2原子团,互为同系物,故A不符合题意;
B、C2H4只能表示乙烯,一定都能使溴水褪色,C4H8可以表示烯烃,也可以表示环烷烃,表示烯烃,一定都能使溴水褪色,表示环烷烃不能能使溴水褪色,故B符合题意;
C、C3H6可以表示烯烃,也可以表示环烷烃,存在同分异构现象,故C不符合题意;
D、单烯烃各同系物的组成通式为CnH2n,最简式相同为CH2,碳元素的质量分数为定值是 ![]() ,故D不符合题意.
,故D不符合题意.
故选:B.
【考点精析】本题主要考查了芳香烃、烃基和同系物的相关知识点,需要掌握分子里含有一个或多个苯环的碳氢化合物,称为芳香烃,其中由一个苯环和饱和烃基组成的芳香烃叫苯的同系物,其通式为CnH2n–6(n≥6)才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】如图所示是几种常见的化学电源示意图,有关说法正确的是

A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池工作时,H+向锌筒移动
C. 铅蓄电池工作过程中,每通过2mol电子,负极质量减轻207g
D. 酸性氢氧燃料电池的正极反应式为O2 + 4H+ + 4e-= 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在(填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为 .
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积.
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡.
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗.
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定.
(5)根据所给数据,写出计算H2C2O4的物质的量浓度的表达式(不必化简):C=mol/L.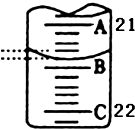
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有“锂”走遍天下。氧化锂(Li2O)是锂电池工业的重要原料,以粗碳酸锂为原料制备氧化锂的一种工艺流程如下:
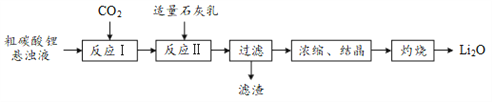
注:常温下,碳酸锂微溶于水,氢氧化锂可溶于水。
(1)反应Ⅰ中通入CO2需加压的原因是______。
(2)反应Ⅱ生成LiOH的化学方程式为______。
(3)浓缩、结晶所得LiOH·H2O通过灼烧得到Li2O。LiOH·H2O中常含有少量的Li2CO3,但该物质对所制Li2O的纯度无影响,其原因是______。
(4)锂离子电池大量应用在手机、笔记本电脑和家用小电器上。标记为Li-ion的锂离子电池的电池反应可表示为:Li + 2Li0.35NiO2![]() 2Li0.85NiO2。
2Li0.85NiO2。
①放电时,负极的电极反应式为______。
②充电时,能量转化形式主要是______。
③锂离子电池使用非水溶液做离子导体的原因是______(用离子方程式表示)。
④安全使用锂离子电池的措施有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意回答下列问题
(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为 .
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
(4)(II)某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55molL﹣1 , 盐酸的浓度为0.5molL﹣1 , 每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2﹣t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
① | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
② | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
③ | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
已知盐酸、NaOH溶液密度近似为1.00gcm﹣3 , 中和后混合液的比热容c═4.18×10﹣3 kJg﹣1℃﹣1 , 则该反应的中和热为△H= .
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会(填“偏大”、“偏小”或“不变”),其原因是 .
(6)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热(填“偏大”、“偏小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() U是重要的核工业原料,下列有关
U是重要的核工业原料,下列有关 ![]() U的说法正确的是( )
U的说法正确的是( )
A.![]() U与
U与 ![]() U互为同素异形体
U互为同素异形体
B.![]() U与
U与 ![]() U互为同位素
U互为同位素
C.![]() U原子核中含有92个中子
U原子核中含有92个中子
D.![]() U原子核外有143个电子
U原子核外有143个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空.
(1)A的结构简式是 , 名称是 .
(2)①的反应类型是 , ②的反应类型是 .
(3)反应④的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是

A. 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
B. 当V=5时:c(CO32—)+c(HCO3-)+c(H2CO3)=c(Cl-)
C. 当V=10时:c(Na+)>c(HCO3-)>c(CO32—)>c(H2CO3)
D. 当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年4月10日,陕西杨凌马拉松比赛中一参赛者在约41公里处突然倒地。少数运动员跑完全程时下肢肌肉会发生抽搐,这是由于随着大量排汗而向外排出了过量的( )
A.水 B.钙盐 C.钠盐 D.尿素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com