
分析 (1)使水的电离平衡向右移动的方法有:升高温度、加入含有弱根离子的盐等,如果溶液呈酸性,说明加入的物质和氢氧根离子反应,导致溶液中氢氧根离子浓度小于氢离子浓度而使溶液呈酸性;
(2)100℃沸水显示中性,根据中性环境下pH试纸的颜色来确定即可;在25℃时,水的pH=7,温度升高,则pH增大,水在任何温度下均为中性.
解答 解:(1)A.向水中加入NaHSO4,NaHSO4电离出氢离子,抑制水电离,平衡逆向移动,导致溶液中C(H+)>C(OH-),溶液呈酸性,故错误;
B.向水中加入Cu(NO3)2,Cu(NO3)2是强酸弱碱盐能水解,铜离子和氢氧根离子结合生成氢氧化铜,从而促进水电离,导致溶液中C(OH-)<C(H+),溶液呈酸性,故正确;
C.水的电离是吸热反应,加热至100℃,促进水电离,溶液C(OH-)=C(H+),溶液呈中性,故错误;
D.向水中加入(NH4)2SO4,(NH4)2SO4是强酸弱碱盐能水解,铵根离子与氢氧根离子结合生成一水合氨,从而促进水电离,导致溶液中C(OH-)<C(H+),溶液呈酸性,故正确;
故选BD;
(2)温度升高会促进水的电离,所以水的pH会减小,所以100℃沸水仍然是中性的,但此时的pH值小于7,pH试纸测定溶液的酸碱性时,试纸为红色,水在任何温度下均为中性的,故答案为:红;中;<;中.
点评 本题考查溶液酸碱性判断及水的电离,为高频考点,侧重考查学生分析判断能力,酸或碱抑制水电离而含有弱离子的盐促进水电离,注意任何温度下纯水都呈中性,但pH不一定为7,为易错点.


科目:高中化学 来源: 题型:多选题
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | T2时CH4的平衡转化率为70.0% | |
| B. | 该反应的△H>0、T1<T2 | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| B. | 同主族元素的简单阴离子还原性越强,其氢化物越稳定 | |
| C. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| D. | IA族与ⅦA族元素间能形成离子化合物或共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
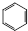 +HNO3$\stackrel{催化剂}{→}$
+HNO3$\stackrel{催化剂}{→}$ +H2O,反应类型取代反应
+H2O,反应类型取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z、Y、X、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| D. | 若X?Y?W组成的简单离子电子层结构相同,则W离子半径最大. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓硝酸做试剂比较铁和铜的金属活动性 | |
| B. | 使用干燥洁净玻璃棒将氯水滴在干燥pH试纸上,测定氯水的pH | |
| C. | 欲检验Br-的存在,可在溶液中先加入氯水、再加入CCl4,振荡、静置,观察下层溶液显橙红色 | |
| D. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液中S2-浓度,金属阳离子浓度变化情况.如果向含有这三种沉淀的混合物中加盐酸,最先溶解的是FeS.
如图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液中S2-浓度,金属阳离子浓度变化情况.如果向含有这三种沉淀的混合物中加盐酸,最先溶解的是FeS.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)机动车尾气和燃烧产生的烟气含氮的氧化物,可以用CH4催化还原NOx消除氮氧化物的污染.
(1)机动车尾气和燃烧产生的烟气含氮的氧化物,可以用CH4催化还原NOx消除氮氧化物的污染.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、K+、SO42- | B. | CO32-、NO3-、HCO3-、Na+ | ||
| C. | Na+、ClO-、AlO2-、NO3- | D. | Cu2+、K+、Na+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com