
【题目】下列有关叙述正确的是
A.高温条件下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应
B.实验室用![]() 与
与![]() 进行下列反应:
进行下列反应:![]()
![]()
![]() ;
;![]() ,当放出
,当放出![]() 热量时,
热量时,![]() 的转化率为
的转化率为![]()
C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进
D.等量的苛性钠溶液分别与pH为2和3的醋酸溶液恰好完全反应,设消耗醋酸溶液的体积依次为![]() 和
和![]() ,则
,则![]()
【答案】B
【解析】
A.反应是否放热与反应条件无关,有些放热反应需在高温条件下进行,例如铝热反应,有些吸热反应在常温下就能进行,例如硫酸铵结晶水合物和氢氧化钡的反应在常温下就能进行,但属于吸热反应,故A错误;
B.当放出![]() 热量时,反应的二氧化硫的物质的量为
热量时,反应的二氧化硫的物质的量为![]() ,则
,则![]() 的转化率为
的转化率为![]() ,故B正确;
,故B正确;
C.常温下,向纯水中通入一定量二氧化硫,二氧化硫和水反应生成亚硫酸,溶液呈酸性,会抑制水的电离,故C错误;
D.由于醋酸为弱酸,不能完全电离,醋酸的浓度越大,则溶液的电离程度越小,设pH=2的醋酸的电离度为a,溶液浓度为x,pH=3的醋酸的电离度为b,溶液浓度为y,则![]() ,
,![]() ,所以有:
,所以有:![]() ,等量的苛性钠溶液分别与pH为2和3的醋酸溶液恰好完全反应,设消耗醋酸溶液的体积依次为
,等量的苛性钠溶液分别与pH为2和3的醋酸溶液恰好完全反应,设消耗醋酸溶液的体积依次为![]() 和
和![]() ,则有
,则有![]() ,则
,则![]() ,故D错误;
,故D错误;
故选:B。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L-1FeCl3溶液:Mg2+、Al3+、MnO4-、SCN-
B.能使紫色石蕊试液变蓝的溶液:Ca2+、Na+、ClO-、I-
C.0.1 mol·L-1 NH4HCO3溶液:Ba2+、K+、OH-、NO3—
D.![]() =10-12的溶液:NH4+、Na+、SO42-、Cl-
=10-12的溶液:NH4+、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 纯碱可用于去油污:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
B. 醋酸去水垢:2H++CaCO3=Ca2++CO2↑+H2O
C. 工业制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D. 实验室制备氢氧化铝:A13++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1 mol NaOH固体溶于1 L水中,所得溶液的物质的量浓度为1 mol/L
B.40 g NaOH固体溶于100 g水中,所得溶液中溶质的质量分数为40%
C.标准状况下,22.4 L HCl气体溶于水中配成1 L溶液,所得溶液的物质的量浓度为1 mol/L
D.1 L物质的量浓度相同的溶液,所含溶质的质量一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是几种盐的溶解度曲线,下列说法正确的是( )
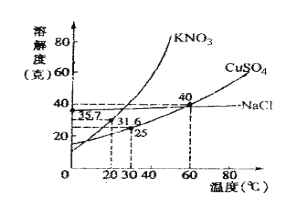
A. 40℃时,将35g食盐溶于100g水中,降温至0℃时,可析出氯化钠晶体
B. 20℃时,硝酸钾饱和溶液的质量分数是31.6%
C. 60℃时,200g水中溶解80g硫酸铜达饱和。当降温至30℃时,可析出30g硫酸铜晶体
D. 30℃时,将35g硝酸钾和35g 食盐同时溶于100g水中,溶液蒸发时,先析出的是氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是( )
A.4v(NH3)=5v(O2)B.5v(O2)=6v(H2O)
C.4v(NH3)=6v(H2O)D.4v(O2)= 5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水溶液中的电离方程式。
①CH3COOH _________ ② NaHSO4 __________________
(2)某温度下,纯水中的c(H+)=2×10-7 mol/L,则此时c(OH-)=______。若温度不变,滴入稀硫酸使c(H+)=5×10-6 mol/L,则由水电离出的c(H+)为_______ 。
(3)常温下,浓度均为0.01 mol/L 的两瓶溶液盐酸和氢氟酸,升高相同的温度,c(Cl-)/ c(F-)的值__________(填“变大”“变小”“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
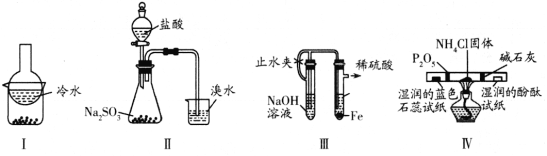
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
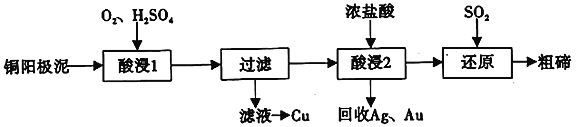
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为____________。
(2)“酸浸2”时温度过高会使Te的浸出率降低,原因是________________________。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为____________;
“还原”过程中,发生反应的离子方程式为_____________________________。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为____________________。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是_____________________。
(5)常温下,向l mol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=__________。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com