
分析 依据配制溶液的体积选择容量瓶规格,依据m=CVM计算需要胆矾的质量,溶液具有均一性,浓度与溶液体积无关,据此解答.
解答 解:配置480mL 0.1mol?L-1CuSO4溶液,实验室没有480mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,需要胆矾的质量m=0.1mol/L×0.5L×250g/mol=12.5g;
溶液具有均一性,浓度与溶液体积无关,所以配制成功后从容量瓶中取出10mL于试管中,则试管中溶液的浓度是0.1mol?L-1.
故答案为:500mL;12.5;0.1.
点评 本题考查了一定物质的量浓度溶液的配制,侧重考查有关物质的量浓度计算,明确相关计算公式及溶液的性质是解题关键,题目难度不大.


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 90% | B. | 80% | C. | 45% | D. | 10% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 托盘天平称取NaCl的质量 | 应选用容量瓶的规格(可供选择的规格100mL、250mL、500mL) | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g水含有的原子数为NA | |
| B. | 4g金属钙变成钙离子时失去的电子数为0.1NA | |
| C. | 1molO2的质量等于1mol氧原子的质量 | |
| D. | 24gO2和24gO3所含的原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
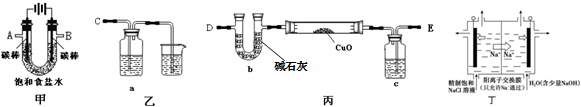
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com