
| A. | 负极反应为:2H2+4OH--4e-═4H2O | |
| B. | 正极反应为:O2+4H++4e-═2 H2O | |
| C. | 电池工作时溶液中的阴离子移向正极 | |
| D. | 电池工作时负极区pH升高,正极区pH下降 |
分析 电解质溶液为30%的氢氧化钾溶液,则负极反应为2H2+4OH--4e-═4H2O,正极反应为O2+2 H2O+4e-═4OH-,阴离子向负极移动,以此来解答.
解答 解:A.负极上氢气失去电子,则负极反应为:2H2+4OH--4e-═4H2O,故A正确;
B.正极上氧气得到电子,正极反应为O2+2 H2O+4e-═4OH-,故B错误;
C.电池工作时溶液中的阴离子移向负极,故C错误;
D.氢氧根离子浓度越大,pH越大,则电池工作时负极区pH下降,正极区pH升高,故D错误;
故选A.
点评 本题考查原电池,为高频考点,把握电极反应、原电池工作原理为解答的关键,侧重分析与应用能力的考查,注意电解质对电极反应的影响,题目难度不大.


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题
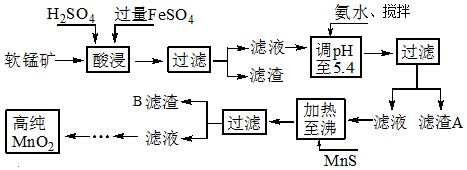
| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-34 | 10-16 | 10-38 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
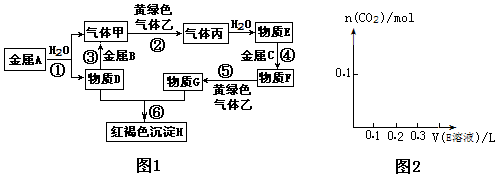
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低,极易被引燃,加热时最好用水浴加热 | |
| B. | 石油裂解、海水制镁、纤维素制火棉都包含化学变化 | |
| C. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| D. | 苹果放在空气中久置变黄和纸张久置变黄原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于1:2 | B. | 小于1:2 | C. | 等于2:1 | D. | 大于2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2H2O(g)=2H2(g)+O2(g)△H=+483.6KJ/mol | |
| B. | H2的燃烧热为241.8 KJ/mol | |
| C. | 浓硫酸与氢氧化钠溶液反应生成1molH2O(I),放出热量也等于57.3KJ | |
| D. | 稀CH3COOH溶液与稀NaOH溶液反应生成1molH2O(l),放出热量小于57.3KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气分子的电子式: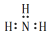 | B. | Mg2+结构示意图: | ||
| C. | 乙酸的结构简式:CH3COOH | D. | 乙醇的分子式C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 催化剂在化学反应前后,化学性质和质量都不变 | |
| C. | 催化剂能改变化学反应速率 | |
| D. | 任何化学反应,都需要催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com