
关于下图装置的说法正确的是
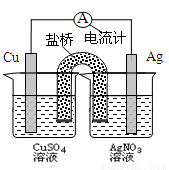
A.银电极是负极
B.铜电极上发生的反应为Cu-2e-=Cu2+
C.外电路中的电子是从银电极流向铜电极。
D.该装置能将电能转化为化学能
科目:高中化学 来源:2014秋广东省广州市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
微量元素是指每种质量不到体重的万分之一,质量总和不到人体质量的千分之一的近二十种元素,这些元素对人体正常代谢和健康起着重要作用。下列元素不是微量元素的是
A.I B.H C.Zn D.Fe
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省高一上学期期中化学试卷(解析版) 题型:填空题
(20分)实验室欲配制0.1 mol / L的NaOH溶液350 mL,回答下列问题:
(1)配制时必须使用的仪器除天平(带砝码)、烧杯、玻璃棒 ;
(2)玻璃棒的作用 ;
(3)用托盘天平称量所需要NaOH的质量为 g;
(4)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤
⑦定容 ⑧冷却 ⑨装瓶贴签。其正确的操作顺序为 ;
(5)定容过程中若不小心超过刻度线,则需 ;
(6)下列操作中会导致溶液实际浓度出现误差吗?请用“偏高”、“偏低”、和“无影响”回答
a 称量时间过长 ;
b 定容时俯视刻度线 ;
c 移液前容量瓶内有少量水 ;
d 定容时,水加多了,后用滴管吸出 ;
e 未洗涤玻璃棒和烧杯 ;
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省高一上学期期中化学试卷(解析版) 题型:选择题
市场上销售的“84”消毒液,其商品标识上有如下叙述: ①本品为无色溶液,呈碱性 ②使用
时加水稀释 ③可对餐具、衣物进行消毒,可漂白浅色衣服。则其有效成份可能是
A.Cl2 B.SO2 C.NaClO D.KMnO4
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省宿州市高二上学期期中化学(理)试卷(解析版) 题型:选择题
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O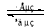 Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e- + OH- =NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH - 向正极移动
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省宿州市高二上学期期中化学(理)试卷(解析版) 题型:选择题
一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c
2Z(g),若X、Y、Z的起始浓度分别为c 、c
、c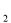 、c
、c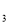 (均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
A.c :c
:c =1:2
=1:2
B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等
D.c 的取值范围为0.04 mol/L<c
的取值范围为0.04 mol/L<c <0.14 mol/L
<0.14 mol/L
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省宿州市高二上学期期中化学(理)试卷(解析版) 题型:选择题
下列叙述不正确的是
A.铁表面镀一层锌,铁件应连接电源的正极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.金属的电化学腐蚀比化学腐蚀更普遍
D.炒过菜的铁锅未清洗易生锈
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省宿州市高一第一学期期中化学试卷(解析版) 题型:选择题
在标准状况下,下列物质中体积最大的是
A.3g H2 B.1mol SO2 C.36g H2O D.6.02×1023个N2
查看答案和解析>>
科目:高中化学 来源:2014秋季甘肃省白银市高二第一学期期中理科化学试卷(解析版) 题型:填空题
(12分)工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g) ? CH3OH(g)
(1)下图表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是 (填“吸热”或“放热”)反应,写出反应的热化学方程式 ;
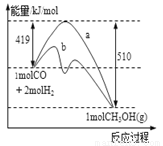
选择适宜的催化剂, (填“能”或“不能”)改变该反应的反应热。
(2)该反应平衡常数K的表达式为K= ,温度升高,平衡常数K (填“增大”、“不变”或“减小”);
(3)恒容条件下,下列措施中能使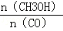 增大的有 。
增大的有 。
a.升高温度 b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com