
分析 (1)①根据物质的性质和质量守恒定律书写化学方程式;
②检验沉淀是否洗净的方法是,取少量洗涤液,检验溶液中溶解的离子是否还存在氯离子;
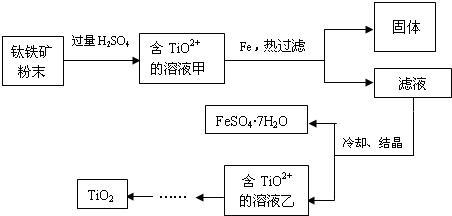
方法二:钛铁矿和过量稀硫酸混合,FeTiO3和稀硫酸反应生成Fe2+、TiO2+,氧化铁和稀硫酸反应生成Fe3+,所以溶液甲中含有Fe2+、TiO2+、Fe3+,然后向溶液中加入Fe,Fe将Fe3+氧化生成Fe2+,然后过滤得到滤渣和滤液,将滤液蒸发浓缩、冷却结晶得到绿矾和含有TiO2+溶液乙,通过一系列反应得到TiO2;
(2)碱性氧化物和酸反应生成盐和水;
(3)FeTiO3+4H+=Fe2++TiO2++2H2O,氧化铁和硫酸反应生成硫酸铁,据此解答即可;
(4)铁有还原性,能还原铁离子;
(5)在800℃条件下,四氯化钛和镁反应生成氯化镁和钛,Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应.
解答 解:(1)①设TiCl4的系数为1,根据元素守恒,TiO2•xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),方程式为TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl,故答案为:TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl;
②沉淀吸附溶液中的Cl-,根据发生反应:Cl-+Ag+═AgCl↓,取最后一次的少量洗涤液,检验溶液中溶解的离子是否还存在,故答案为:取最后一次的少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净;
(2)氧化铁和硫酸反应生成硫酸铁和水,离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(3)Fe2O3+6H+=2Fe3++3H2O,FeTiO3+4H+=Fe2++TiO2++2H2O,所以溶液中还存在的阳离子是Fe3+、Fe2+,故答案为:Fe3+、Fe2+;
(4)该溶液中含有铁离子,铁具有还原性,能将铁离子氧化生成亚铁离子且不引进新的杂质,所以铁的作用是:将Fe3+转化为Fe2+,故答案为:将Fe3+转化为Fe2+;
(5)在800℃条件下,四氯化钛和镁反应生成氯化镁和钛,反应方程式为:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+TiMg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应,故答案为:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti; 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用.
点评 本题考查学生对工艺流程理解、阅读题目获取信息能力、氧化还原反应及方程式的书写等,难度中等,理解工艺流程是关键,需要学生具有阅读题目获取信息能力和灵活运用基础知识分析问题、解决问题能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 :3,3,5-三甲基庚烷;
:3,3,5-三甲基庚烷;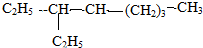 :3-乙基辛烷;
:3-乙基辛烷;查看答案和解析>>
科目:高中化学 来源: 题型:解答题


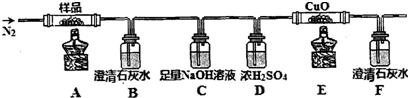
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
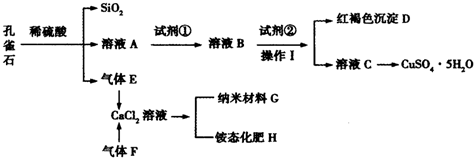
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 23.3g | 19.7g |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑦ | B. | 全部 | C. | ③④⑤⑦⑧ | D. | ①②⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com