
| A、氘(D)原子核外有1个电子 | B、是H的同位素 | C、自然界中没有D原子存在 | D、D+质量数为2 |
科目:高中化学 来源: 题型:
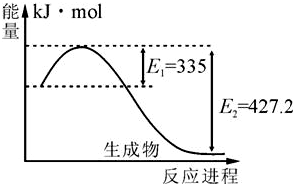 氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: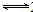 2NH3(g)△H<0,得到如下数据:
2NH3(g)△H<0,得到如下数据:| 实验组 | 温度/℃ | 起始量/mol | 2分钟/mol | 平衡常数 | |
| H2 | N2 | NH3 | |||
| 1 | 298 | 6 | 2 | 1.2 | 4.1×106 |
| 2 | 398 | 3 | 1 | 0.8 | K1 |
| [c(NH3)]2 |
| c(N2)[c(H2)]3 |
| [c(NH3)]2 |
| c(N2)[c(H2)]3 |
 NH3?HDO+D+
NH3?HDO+D+ NH3?HDO+D+
NH3?HDO+D+查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| (一定条件) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| (一定条件) |
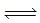 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=| C(N2)?[C (H2) ]3 |
| [C (NH3)]2 |
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1H与D互称同位素 | B、1H→D通过化学变化不能实现 | C、H2O与D2O互称同素异形体 | D、1H218O与D216O的物理性质不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com