
| A. | 原子序数:Y>X>Z>W | B. | 离子半径:X+>Y2+>Z->W2- | ||
| C. | 原子最外层电子数:Z>W>Y>X | D. | 原子半径:X>Y>W>Z |
分析 X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,所以ZW的电子层比XY少一层,设原子序数分别为a、b、c、d,则由a-1=b-2=c+1=d+2,则原子序数Y>X>Z>W,结合元素周期律的递变规律解答该题.
解答 解:X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,所以ZW的电子层比XY少一层,设原子序数分别为a、b、c、d,则由a-1=b-2=c+1=d+2,则原子序数Y>X>Z>W,
A.由以上分析可知原子序数:Y>X>Z>W,故A正确;
B.核外电子排布相同的离子,核电荷数越大,离子半径越小,应为W2->Z->X+>Y2+,故B错误;
C.根据离子所带电荷可知X、Y、Z、W原子最外层电子数分别为1、2、7、6,则原子最外层电子数Z>W>Y>X,故C正确;
D.Z、W处于同一周期,且处于X、Y所在周期上一周期,原子序数Y>X>Z>W,同周期元素原子序数越大,半径越小,所以原子半径X>Y,W>Z,原子核外电子层数越多,半径越大,所以X>Y>W>Z,故D正确.
故选B.
点评 本题考查元素周期表和元素周期律的知识点,该知识点是高考考查的重点和热点,本题难度适中,根据离子的结构特征判断原子序数的关系为解答该题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X 的能量一定高于M | |
| B. | Y 的能量一定高于N | |
| C. | X 和Y 的总能量一定高于M 和N 的总能量 | |
| D. | 因该反应为放热反应,故不必加热就可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数为1NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA | |
| C. | 常温常压下,22.4L CO2气体含有原子数为3NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与空气 | B. | 铝盐与氢氧化钠溶液 | ||
| C. | CO2通入石灰水 | D. | 过氧化钠与水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 需区分的物质 | 实验方法 |
| A | 白酒和白醋 | ①观察颜色②闻气味 |
| B | 食盐和白糖 | ①加稀盐酸②加水溶解 |
| C | 合成纤维和天然纤维 | ①点燃闻气味②观察色泽 |
| D | 酸性厕所清洁剂与碱性厨房清洁剂 | ①测pH②加石灰石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
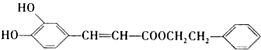 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: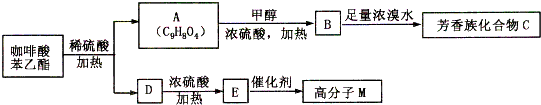
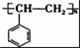 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
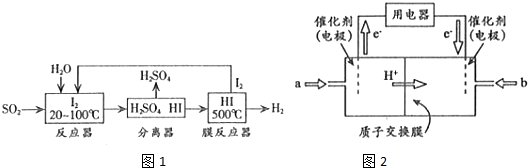
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com